题目内容
17.下列有关能量变化的说法正确的是( )| A. | 2SO2(g)+02(g) $?_{500℃}^{V_{2}O_{5}}$2SO3(g)△H=-196.6 kJ/mol,则2molSO2完全反应放出热量等于196.6kJ | |
| B. | “冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 | |
| C. | 已知C(s,石墨)=C(s,金刚石)△H=+1.9 kJ/mol,则金刚石比石墨稳定 | |
| D. | 氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
分析 A、2SO2(g)+02(g) $?_{500℃}^{V_{2}O_{5}}$2SO3(g)△H=-196.6 kJ/mol,表示2mol二氧化硫完全转化;
B、H2O(l)=H2O(s)△H<0,液态水到固态水,放热,所以水的能量高;
C、石墨完全转化为金刚石时,要吸收能量,说明金刚石能量高于石墨,能量越低越稳定;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量.
解答 解:A、2SO2(g)+02(g) $?_{500℃}^{V_{2}O_{5}}$2SO3(g)△H=-196.6 kJ/mol,表示2mol二氧化硫完全转化,所以2molSO2完全反应放出热量等于196.6kJ,故A正确;
B、H2O(l)=H2O(s)△H<0,液态水到固态水,放热,所以水的能量高,故B错误;
C、石墨完全转化为金刚石时,要吸收能量,说明金刚石能量高于石墨,能量越低越稳定,所以石墨比金刚石稳定,故C错误;
D、氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ/mol,故D错误;
故选A.
点评 本题考查了化学反应能量变化,热化学方程式书写,燃烧热概念的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.我国汉书中记载:“高奴县有洧水,可燃”,沈括在《梦溪笔谈》对洧水的使用有如下描述:“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也”,对上述史实记载分析正确的是( )
| A. | 该物质属于纯净物 | B. | 该物质可能属于无机化合物 | ||
| C. | 该物质是由同一类烃组成的混合物 | D. | 烟是该物质不完全燃烧的产物 |
8.汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源.德国大众汽车尾气检测造假事件引起全世界震惊.根据下列示意图回答有关问题:
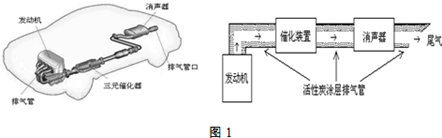
(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1,其能量变化示意图如下:
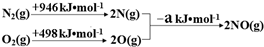
则NO中氮氧键的键能为632kJ•mol-1;
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0 则△G>0;
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD;
A.增加排气管长度 B.增大尾气排放口
C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
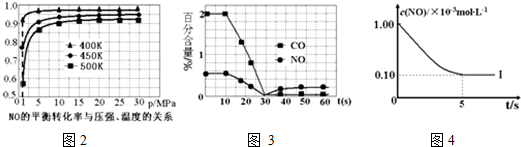
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa;
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度);
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
根据坐标图4,计算400K时该反应的平衡常数为5000L•mol-1.

(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1,其能量变化示意图如下:

则NO中氮氧键的键能为632kJ•mol-1;
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0 则△G>0;
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD;
A.增加排气管长度 B.增大尾气排放口
C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).

①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa;
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度);
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
5.下列与化学有关的说法中错误的是( )
| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb-Ti)合金,通常它的熔点一般比纯钛要高. |
2.用质量相同的铁单质与下列条件下相同体积的硫酸反应时,生成氢气速率最快的是( )
| A. | 20℃铁片 1mol/L硫酸 | B. | 30℃铁粉 1mol/L硫酸 | ||
| C. | 30℃铁粉 2mol/L硫酸 | D. | 30℃铁片 18mol/L硫酸 |
9.我国古代做衣服的主要原料是麻和丝.下列有关说法中不正确的是( )
| A. | 麻的主要成分表示为(C6H1206) | |
| B. | 丝的主要成分是蛋白质 | |
| C. | 麻和丝生要成分均属于高分子化合物 | |
| D. | 麻和丝可以通过灼烧进行区分 |
6.下列各组物质中,化学键类型相同,晶体类型也相同的是( )
| A. | CH4和 H2O | B. | SiC和 HCl | C. | Ar和Si | D. | SiO2 和 CO2 |
7.在体积恒定的密闭容器中发生可逆反应:H2(g)+I2(g)?2HI(g).则下列说法能说明上述反应达到平衡状态的是( )
| A. | 混合气体密度恒定不变 | B. | 混合气体的颜色不再改变 | ||
| C. | H2、I2、HI 的浓度相同 | D. | I2在混合气体中体积分数不变 |
