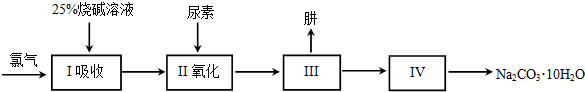
题目内容
12.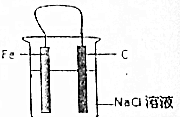 有关Fe-C-Nac1溶液构成的原电池中,叙述错误的是( )
有关Fe-C-Nac1溶液构成的原电池中,叙述错误的是( )| A. | 铁片为负极,碳棒为正极 | |
| B. | 铁被腐蚀,碳棒上有氯气放出 | |
| C. | 碳棒附近的溶液可使酚酞变红 | |
| D. | 导线上有电流通过,电流方向是由碳极流向铁极 |
分析 Fe-C-Nac1溶液构成的原电池中,活泼金属作负极,失电子发生氧化反应;较不活泼金属作正极,溶液中阳离子得电子发生还原反应,所以电子从负极沿外电路流向正极.
解答 解:A、Fe-C-Nac1成的原电池中,活泼金属锌作负极,铁片为负极,碳棒为正极,故A正确;
B、Fe-C-Nac1构成的原电池中,铁片为负极,碳棒为正极,溶液中阳离子得电子发生还原反,铁被腐蚀,碳棒上氧气得电子生成氢氧根,无气放出,故B错误;
C、碳棒为正极,发生反应为O2+2H2O+4e-=4OH-,碱性增强,故碳棒附近的溶液可使酚酞变红故,C正确;
D、电子从负极沿外电路流向正极,所以外电路电子流入的一极为正极,电子流出的一极为负极,故D正确.
故选:B.
点评 本题考查了原电池原理,难度不大,注意原电池溶液中阴阳离子的移动方向,这是易错点.

练习册系列答案
相关题目
3.下列实验方案不能达到实验目的是( )
| 选项 | 实验方案 | 实验目的 |
| A | 向酸性KMnO4溶液中滴加草酸溶液,观察紫色是否消失 | 验证草酸具有还原性 |
| B | 向相同浓度的NaBr和KI溶液中分别滴加足量氯水,观察溶液颜色变化 | 比较溴元素和碘元素的非金属性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 将Mg(OH)2沉淀转入烧杯中,加足量稀硫酸溶解,加热浓缩,冷却结晶 | 制备硫酸镁晶体 |
| A. | A | B. | B | C. | C | D. | D |
20.化学与社会、生活、技术和环境密切相关.下列有关说法中错误的是( )
| A. | 德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| C. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| D. | 绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
7.向含有下列微粒的溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使该微粒浓度下降的是( )
| A. | Fe3+ | B. | HS- | C. | 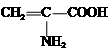 | D. | C6H5O- |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 0.1mol•L-1Na2S溶液中所含S2-总数小于0.1NA | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 25℃时,50g 98%浓硫酸和50g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4L气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1mol C3H6分子中碳碳共价键数为2NA |