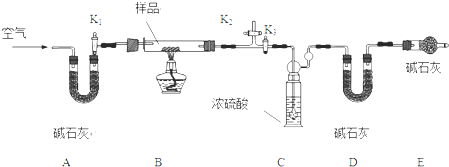
题目内容
100毫升含HNO3、H2SO4的稀溶液中,加入9.6克铜充分反应,铜全溶,产生2.24升NO(标准状况).同体积的混合酸恰好与250毫升2mol/L的NaOH完全中和.
计算原混合酸中HNO3的物质的量浓度的取值范围
H2SO4的物质的量浓度的取值范围 .
计算原混合酸中HNO3的物质的量浓度的取值范围
H2SO4的物质的量浓度的取值范围
考点:有关范围讨论题的计算
专题:
分析:铜与稀HNO3反应离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,同体积的混合酸恰好与250毫升2mol/L的NaOH完全中和,说明混酸中的氢离子的物质的量为0.5mol.
采用假设法进行计算:若氢离子全部是硝酸提供,则硝酸的物质的量最大是0.5mol,若硝酸全部被还原为NO,则硝酸的物质的量等于2.24L标准状况下的NO的物质的量;当硝酸的物质的量最小时,硫酸的物质的量最大,硝酸物质的量最大时,硫酸的物质的量最小为0,实际是硝酸和硫酸的混合酸,所以硫酸的浓度的取值范围是 0<C(H2SO4),据此分析计算.
采用假设法进行计算:若氢离子全部是硝酸提供,则硝酸的物质的量最大是0.5mol,若硝酸全部被还原为NO,则硝酸的物质的量等于2.24L标准状况下的NO的物质的量;当硝酸的物质的量最小时,硫酸的物质的量最大,硝酸物质的量最大时,硫酸的物质的量最小为0,实际是硝酸和硫酸的混合酸,所以硫酸的浓度的取值范围是 0<C(H2SO4),据此分析计算.
解答:
解:9.6克铜的物质的量n(Cu)=
=
=0.15mol,2.24L标准状况下的NO的物质的量n(NO)=
=
,250毫升2mol/L的NaOH n(NaOH)=cv=2mol/L×0.25L=0.5mol,同体积的混合酸恰好反应说明混酸中的氢离子的物质的量为0.5mol,
假设1:0.5mol氢离子若全部是硝酸提供,则硝酸的物质的量最大是0.5mol,C(HNO3)=
=
=5mol/L,因含有硫酸,所以C(HNO3)<5 mol/L,
假设2:若硝酸全部被还原为NO,则硝酸的物质的量最小是0.1mol,C(HNO3)=
=
=1mol/L,
则原混合酸中HNO3的物质的量浓度的取值范围为1 mol/L≤C(HNO3)<5 mol/L,
混酸中的氢离子的物质的量为0.5mol,当硝酸的物质的量最小时0.1mol,硫酸的物质的量最大是0.2mol,
C(H2SO4)≤2mol/L,
硝酸物质的量最大0.5mol时,硫酸的物质的量最小为0,实际是硝酸和硫酸的混合酸,所以硫酸的浓度的取值范围是 0<C(H2SO4)≤2 mol/L.
故答案为:1 mol/L≤C(HNO3)<5 mol/L;0<C(H2SO4)≤2 mol/L.
| m |
| M |
| 9.6g |
| 64g/mol |
| v |
| vm |
| 2.24L |
| 22.4L/mol |
假设1:0.5mol氢离子若全部是硝酸提供,则硝酸的物质的量最大是0.5mol,C(HNO3)=
| n |
| v |
| 0.5mol |
| 0.1L |
=5mol/L,因含有硫酸,所以C(HNO3)<5 mol/L,
假设2:若硝酸全部被还原为NO,则硝酸的物质的量最小是0.1mol,C(HNO3)=
| n |
| v |
| 0.1mol |
| 0.1L |
则原混合酸中HNO3的物质的量浓度的取值范围为1 mol/L≤C(HNO3)<5 mol/L,
混酸中的氢离子的物质的量为0.5mol,当硝酸的物质的量最小时0.1mol,硫酸的物质的量最大是0.2mol,
C(H2SO4)≤2mol/L,
硝酸物质的量最大0.5mol时,硫酸的物质的量最小为0,实际是硝酸和硫酸的混合酸,所以硫酸的浓度的取值范围是 0<C(H2SO4)≤2 mol/L.
故答案为:1 mol/L≤C(HNO3)<5 mol/L;0<C(H2SO4)≤2 mol/L.
点评:本题考查硫酸、硝酸的性质,侧重于学生的分析能力和计算能力的考查,为高频考点,难度中等,注意结合反应的方程式从质量守恒的角度解答该题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
a g Mg、Al合金完全溶解在C1 mol?L-1、V1L HCl溶液中,产生b g H2.再向反应后的溶液中加入C2mol?L-1、V2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g.下列关系错误的是( )
A、铝为
| ||
B、C1=
| ||
| C、d=a+17b | ||
| D、与金属反应后剩余盐酸为(C1V1-b)mol |
有机物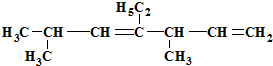 的名称是( )
的名称是( )
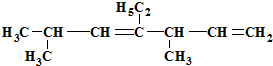 的名称是( )
的名称是( )| A、2,5-二甲基-4-乙基-3,6-庚二烯 |
| B、1,1,4-三甲基-3-乙基-2,5-己二烯 |
| C、3,6-二甲基-4-乙基-1,4-庚二烯 |
| D、2,5-二甲基-4-乙基-3,6-二庚烯 |
工业上用洗净的废铜屑作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采用的方法是( )
| A、Cu+HNO3(浓)→Cu(NO3)2 |
| B、Cu+HNO3(稀)→Cu(NO3)2 |
| C、Cu+空气→CuO CuO+HNO3→Cu(NO3)2 |
| D、Cu+浓硫酸→CuSO4 CuSO4+Ba(NO3)2→Cu(NO3)2 |
下列有关酯的叙述,不正确的是( )
| A、羧酸与醇在强酸的存在下加热,可得到酯 |
| B、乙酸和甲醇发生酯化反应生成甲酸乙酯 |
| C、酯化反应的逆反应是水解反应 |
| D、果类和花草中存在着有芳香气味的低级酯 |
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为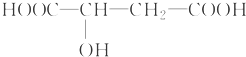 .下列相关说法不正确的是( )
.下列相关说法不正确的是( )
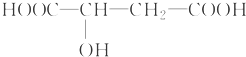 .下列相关说法不正确的是( )
.下列相关说法不正确的是( )| A、苹果酸在一定条件下能发生酯化反应 |
| B、苹果酸在一定条件下能发生催化氧化反应 |
| C、1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下) |
| D、1 mol苹果酸与Na2CO3溶液反应一定消耗2 mol Na2CO3 |
下列叙述或操作正确的是( )
| A、浓硫酸具有强氧化性,稀硫酸无氧化性 |
| B、浓硫酸滴到蓝矾上,蓝矾变成白色粉末,体现了浓硫酸的脱水性 |
| C、稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌 |
| D、浓硫酸与铜的反应中,浓硫酸仅表现强氧化性 |