题目内容
取一定量含FeO、Fe3O4 和Fe2O3的固体混合物,将其分成两份并进行下列转化:若硝酸恰好完全反应,则所加稀HNO3的物质的量浓度为( )
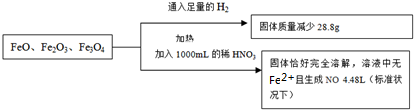

| A、3.8mol?L-1 |
| B、4.0mol?L-1 |
| C、4.4mol?L-1 |
| D、3.6mol?L-1 |
考点:有关混合物反应的计算
专题:
分析:FeO、Fe3O4 和Fe2O3的固体混合物通入足量的氢气,FeO、Fe3O4 和Fe2O3被还原成Fe单质,根据减少的质量即为氧的质量,根据几种氧化物中O为-2价,可知Fe元素所带正电荷总数,Fe元素失去一定量的电子后所带正电荷总数等于硝酸根离子所带负电荷总数,结合电子守恒分析.
解答:
解:FeO、Fe3O4 和Fe2O3的固体混合物通入足量的氢气,FeO、Fe3O4 和Fe2O3被还原成Fe单质,减少的质量即为氧的质量,则n(O)=
=1.8mol,
在这三种化合物中O元素为-2价,则O元素所带负电荷为1.8mol×2=3.6mol,由电荷守恒可知,Fe元素所带正电荷为3.6mol;
Fe元素失去一定量的电子后所带正电荷总数等于硝酸根离子所带负电荷总数,Fe元素失去的电子的物质的量等于生成NO时N元素得到的电子的物质的量,
n(电子)=
×(5-2)=0.6mol,
则硝酸铁中硝酸根离子n(NO3-)=3.6mol+0.6mol=4.2mol,
反应前硝酸的物质的量=反应后硝酸铁中硝酸根离子的物质的量+NO的物质的量,
即n(HNO3)=n(NO3-)+n(NO)=4.2mol+0.2mol=4.4mol,
所以所加稀HNO3的物质的量浓度为
=4.4mol?L-1,
故选:C.
| 28.8g |
| 16g/mol |
在这三种化合物中O元素为-2价,则O元素所带负电荷为1.8mol×2=3.6mol,由电荷守恒可知,Fe元素所带正电荷为3.6mol;
Fe元素失去一定量的电子后所带正电荷总数等于硝酸根离子所带负电荷总数,Fe元素失去的电子的物质的量等于生成NO时N元素得到的电子的物质的量,
n(电子)=
| 4.48L |
| 22.4L/mol |
则硝酸铁中硝酸根离子n(NO3-)=3.6mol+0.6mol=4.2mol,
反应前硝酸的物质的量=反应后硝酸铁中硝酸根离子的物质的量+NO的物质的量,
即n(HNO3)=n(NO3-)+n(NO)=4.2mol+0.2mol=4.4mol,
所以所加稀HNO3的物质的量浓度为
| 4.4mol |
| 1L |
故选:C.
点评:本题考查Fe及化合物的性质,侧重电子守恒和原子守恒的思想的考查,此思想是解决化学计算的简洁方法,应用比较广泛,题目难度中等.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
下列说法正确的是( )
| A、乙烷与氯气在光照条件下发生加成反应 |
| B、将石蜡油(液态烷烃混合物)加强热分解生成的气体都是烷烃 |
| C、甲苯能够使溴的四氯化碳溶液和酸性的高锰酸钾溶液褪色 |
| D、乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸 |
现有2mol/L稀硫酸30mL,往其中加入1.7gNaNO3晶体,充分溶解,该混和液最多可溶解铜的物质的量为( )
| A、0.03mol |
| B、0.045mol |
| C、0.0225mol |
| D、0mol |
2011年3月11日日本发生9.0级的强震并引发海啸和核泄露,核电站周围检测到放射性物质碘131,下列有关说法正确的是( )
| A、核裂变是一种化学变化 |
| B、131I 与127I互为同素异形体 |
| C、131I 原子的中子数为78 |
| D、碘在周期表中位于第四周期ⅦA族 |
有关Na2CO3和NaHCO3的叙述中正确的是( )
| A、相同质量的Na2CO3和NaHCO3与足量盐酸作用时,碳酸氢钠反应速率更快,产生的气体质量相同 |
| B、NaHCO3俗名:小苏打.Na2CO3俗名:大苏打 |
| C、Na2CO3和NaHCO3均可与澄清石灰水反应 |
| D、Na2CO3和NaHCO3均可与NaOH溶液反应 |
热水法制Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O下列说法正确的是( )
| A、将纳米Fe3O4分散在水中没有丁达尔现象 |
| B、将纳米Fe3O4分散在水中Fe3O4不能透过滤纸 |
| C、每生成1 mol Fe3O4反应转移的电子数为4 NA |
| D、反应物OH-的化学计量数x=2 |


 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: