题目内容
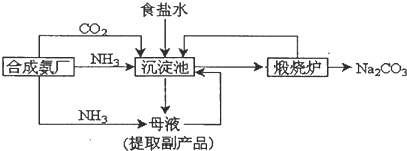
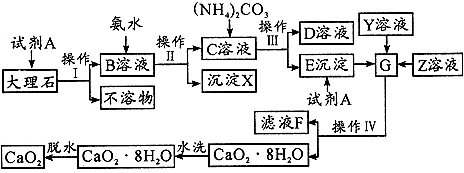
根据侯德榜提出的工艺,制碱厂设计生产流程如下:
(1)该流程中可循环利用的物质是 .向母液中通氨气,并加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 .
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(2)检验产品纯碱中是否含有NaCl的试剂是 .
(3)某学习小组在实验室模拟制碱有关工艺.
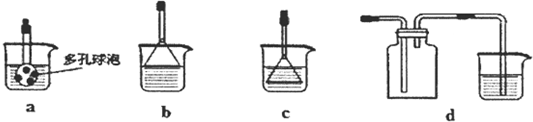
①若利用氯化铵和熟石灰制取氨气,反应方程式是 ,制得的氨气可用下列盛有NaCl溶液的 装置吸收.
②已知用饱和NaNO2与NH4C1溶液加热可制取氮气.该小组模拟工业合成氨设计如下装置:
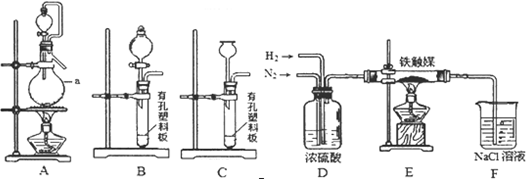
仪器a的名称是 ;氢气的发生装置应选用 ;A装置加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 .装置D的作用是①除去N2、H2中的水;② ;③观察并调节气泡速率,控制N2、H2的比例.
有同学认为:从氨合成器(E装置)中出来的气体连续通入F装置的NaCl溶液中,可能会发生倒吸.你认为是否可能并说明理由. .
(1)该流程中可循环利用的物质是

A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(2)检验产品纯碱中是否含有NaCl的试剂是
(3)某学习小组在实验室模拟制碱有关工艺.
①若利用氯化铵和熟石灰制取氨气,反应方程式是

②已知用饱和NaNO2与NH4C1溶液加热可制取氮气.该小组模拟工业合成氨设计如下装置:

仪器a的名称是
有同学认为:从氨合成器(E装置)中出来的气体连续通入F装置的NaCl溶液中,可能会发生倒吸.你认为是否可能并说明理由.
考点:纯碱工业(侯氏制碱法)
专题:实验题
分析:根据反应方程式确定母液中的溶质,根据氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来分析;同时通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(1)工艺流程中设计循环来提高原料的利用率,根据氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来分析;同时通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(2)根据氯离子的检验方法选择试剂;
(3)①实验室制备氨气的方法是利用固体氯化铵和氢氧化钙加热反应生成氨气;氨气极易溶于水,要注意防止倒吸;
②根据仪器的特点确定其名称,氢气的制取采用金属锌和稀盐酸的反应,根据装置的特点确定装置具有的作用;氮气和氢气合成氨气的反应是可逆的,得到的氨气中混有氮气和氢气.
(1)工艺流程中设计循环来提高原料的利用率,根据氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来分析;同时通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(2)根据氯离子的检验方法选择试剂;
(3)①实验室制备氨气的方法是利用固体氯化铵和氢氧化钙加热反应生成氨气;氨气极易溶于水,要注意防止倒吸;
②根据仪器的特点确定其名称,氢气的制取采用金属锌和稀盐酸的反应,根据装置的特点确定装置具有的作用;氮气和氢气合成氨气的反应是可逆的,得到的氨气中混有氮气和氢气.
解答:
解:根据联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应过程是向氨化的饱和氯化钠溶液中通入二氧化碳气体没说错碳酸氢钠晶体和氯化铵溶液,过滤得到碳酸氢钠固体,加热分解得到纯碱;
(1)整个生产流程中可进行循环使用的主要物质是NaCl、CO2,根据NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入的氨气和水反应生成一水合氨,一水合氨电离出铵根离子,铵根离子浓度增大有利于析出氯化铵,所以选项A正确;
通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度所以选项C正确,
故答案为:c;AC;
(2)要检验产品碳酸钠中是否含有氯化钠,实际上就是检验氯离子的存在,可先滴加过量稀硝酸,排除碳酸根离子的干扰,在滴加硝酸银溶液,如果有白色沉淀生成,则含有氯离子,
故答案为:稀HNO3和AgNO3溶液;
(3)①实验室制备氨气的方法是利用固体氯化铵和氢氧化钙加热反应生成氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,氨气极易溶于水,装置b可以防止倒吸,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;b;
②仪器a的名称是蒸馏烧瓶,用金属锌和稀盐酸的反应产生氢气,是固体和液体不加热制取气体的方法,选择装置B,A装置加热片刻后,即应移去酒精灯以防反应物冲出,因本反应放热,不需持续加热,装置D中盛有浓硫酸,它的作用可以吸收水分,还可以使N2、H2混合均匀,还可以观察并调节气泡速率,控制N2、H2的比例,该反应生成的氨气中含有大量难溶于水的N2和H2,所以氨气溶于水不会导致倒吸,
故答案为:蒸馏烧瓶;B;因本反应放热,不需持续加热;使N2、H2混合均匀;否,该反应生成的氨气中含有大量难溶于水的N2和H2,氨气溶于水气压降低不是很大.
(1)整个生产流程中可进行循环使用的主要物质是NaCl、CO2,根据NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入的氨气和水反应生成一水合氨,一水合氨电离出铵根离子,铵根离子浓度增大有利于析出氯化铵,所以选项A正确;
通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度所以选项C正确,
故答案为:c;AC;
(2)要检验产品碳酸钠中是否含有氯化钠,实际上就是检验氯离子的存在,可先滴加过量稀硝酸,排除碳酸根离子的干扰,在滴加硝酸银溶液,如果有白色沉淀生成,则含有氯离子,
故答案为:稀HNO3和AgNO3溶液;
(3)①实验室制备氨气的方法是利用固体氯化铵和氢氧化钙加热反应生成氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
| ||
②仪器a的名称是蒸馏烧瓶,用金属锌和稀盐酸的反应产生氢气,是固体和液体不加热制取气体的方法,选择装置B,A装置加热片刻后,即应移去酒精灯以防反应物冲出,因本反应放热,不需持续加热,装置D中盛有浓硫酸,它的作用可以吸收水分,还可以使N2、H2混合均匀,还可以观察并调节气泡速率,控制N2、H2的比例,该反应生成的氨气中含有大量难溶于水的N2和H2,所以氨气溶于水不会导致倒吸,
故答案为:蒸馏烧瓶;B;因本反应放热,不需持续加热;使N2、H2混合均匀;否,该反应生成的氨气中含有大量难溶于水的N2和H2,氨气溶于水气压降低不是很大.
点评:本题考查了侯德榜制碱法实验方案的设计,明确碳酸钠、碳酸氢钠、氨气、二氧化碳的性质,掌握工艺流程和反应原理是解题关键,题目难度中等.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案
相关题目
修缮南京明长城需要用到大量氢氧化钙.氢氧化钙的俗称是( )
| A、火碱 | B、纯碱 |
| C、熟石灰 | D、生石灰 |
取一定量含FeO、Fe3O4 和Fe2O3的固体混合物,将其分成两份并进行下列转化:若硝酸恰好完全反应,则所加稀HNO3的物质的量浓度为( )
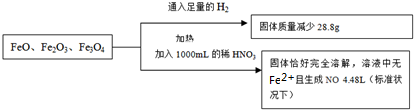

| A、3.8mol?L-1 |
| B、4.0mol?L-1 |
| C、4.4mol?L-1 |
| D、3.6mol?L-1 |
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释正确的是( )
| A、氢气与氯气见光发生爆炸,说明氢气与氯气具有的总能量小于氯化氢 |
| B、浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色物质生成且能溶于浓硝酸 |
| C、由于碳燃烧时放出大量的热,所以碳与氧气的反应不需要任何条件 |
| D、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
下列反应的离子方程式书写正确的是( )
| A、金属钠和水的反应:Na+2H2O=Na++OH-+H2↑ |
| B、向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3+2HClO |
| C、过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O |
| D、过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
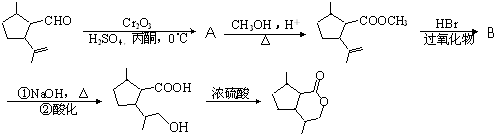
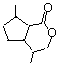 的同分异构体C的结构简式为
的同分异构体C的结构简式为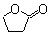 的合成路线图(无机试剂任选),合成路线流程图示例如下:CH3CH2OH
的合成路线图(无机试剂任选),合成路线流程图示例如下:CH3CH2OH