题目内容
热水法制Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O下列说法正确的是( )
| A、将纳米Fe3O4分散在水中没有丁达尔现象 |
| B、将纳米Fe3O4分散在水中Fe3O4不能透过滤纸 |
| C、每生成1 mol Fe3O4反应转移的电子数为4 NA |
| D、反应物OH-的化学计量数x=2 |
考点:氧化还原反应,铁的氧化物和氢氧化物
专题:氧化还原反应专题
分析:由电荷守恒可知,(+2)×3+(-2)×2+x×(-1)=-2,解得x=4,反应中Fe元素的化合价升高,S元素的化合价升高,O元素的化合价降低,以此来解答.
解答:
解:A.纳米Fe3O4粒子直径介于1~100nm之间,将纳米Fe3O4分散在水中可形成胶体,具有丁达尔效应,故A错误;
B.胶体粒子可透过滤纸,但不能透过半透膜,故B错误;
C.每生成1mol Fe3O4,只有1mol氧气得到电子,则反应转移的电子总数为1mol×2×(2-0)=4mol,故C正确;
D.电荷守恒可知,(+2)×3+(-2)×2+x×(-1)=-2,解得x=4,故D错误.
故选C.
B.胶体粒子可透过滤纸,但不能透过半透膜,故B错误;
C.每生成1mol Fe3O4,只有1mol氧气得到电子,则反应转移的电子总数为1mol×2×(2-0)=4mol,故C正确;
D.电荷守恒可知,(+2)×3+(-2)×2+x×(-1)=-2,解得x=4,故D错误.
故选C.
点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,把握反应中元素的化合价变化为解答的关键,侧重电子守恒、电荷守恒分析与应用,题目难度不大.

练习册系列答案
相关题目
取一定量含FeO、Fe3O4 和Fe2O3的固体混合物,将其分成两份并进行下列转化:若硝酸恰好完全反应,则所加稀HNO3的物质的量浓度为( )
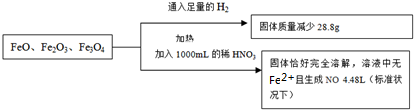

| A、3.8mol?L-1 |
| B、4.0mol?L-1 |
| C、4.4mol?L-1 |
| D、3.6mol?L-1 |
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释正确的是( )
| A、氢气与氯气见光发生爆炸,说明氢气与氯气具有的总能量小于氯化氢 |
| B、浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色物质生成且能溶于浓硝酸 |
| C、由于碳燃烧时放出大量的热,所以碳与氧气的反应不需要任何条件 |
| D、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
下列反应的离子方程式书写正确的是( )
| A、金属钠和水的反应:Na+2H2O=Na++OH-+H2↑ |
| B、向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3+2HClO |
| C、过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O |
| D、过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
下列离子方程式正确的是(??)( )
| A、澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H20 |
| B、碳酸钠溶液与盐酸反应Na2CO3+2H+?=2Νa++H2O+CO2↑ |
| C、氢氧化铜与稀硫酸反应Cu(OH)2+2H+=Cu2++2H2O |
| D、稀硫酸与氢氧化钡溶液反应H++OH-+Ba2++SO42-=H2O+BaSO4↓ |
用NA表示阿伏伽德罗常数的值.下列叙述中正确的是( )
| A、7.8g Na2S和7.8g Na2O2中含有阴离子的数目均为0.1NA |
| B、相同物质的量的OH-和CH3+含有相同数目的电子 |
| C、NA个H2分子与0.5NA个CO分子所占的体积比一定是3:1 |
| D、25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA |
