题目内容
14.某种有机物2mol在氧气中充分燃烧,共消耗5mol氧气,生成二氧化碳和水各4mol,由此可以得到的结论是( )| A. | 该有机物分子中不含有氧原子 | B. | 该有机物分子中含一个氧原子 | ||
| C. | 该有机物一个分子中含2个氧原子 | D. | 该物质结构简式为CH3CHO |
分析 生成二氧化碳和水各4mol,含O原子为12mol,共消耗5mol氧气,由氧原子守恒可知有机物含氧原子,根据原子守恒确定有机物分子式,进而确定可能的结构简式.
解答 解:某种有机物2mol在氧气中充分燃烧,生成二氧化碳和水各4mol,
生成物中O原子的物质的量为n(O)=n(H2O)+2n(CO2)=4mol+4mol×2=12mol,
有机物2mol在氧气中充分燃烧,共消耗5mol氧气,n(O)=5mol×2=10mol,
所以2mol该有机物中n(O)=12mol-10mol=2mol,
则有机物分子中C原子数目为$\frac{4mol}{2mol}$=2、H原子数目为$\frac{4mol×2}{2}$=4、O原子数目为$\frac{2mol}{2mol}$=1,
故有机物分子式为C2H4O,
有机物的结构简式为CH3CHO或 ,
,
故选B.
点评 本题考查有机物分子式确定,掌握燃烧法利用原子守恒确定有机物的分子式,有利于基础知识的巩固.

练习册系列答案
相关题目
4.关于下列图示的说法中错误的是( )


| A. | 用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集H2气体 | |
| C. | 图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为放热反应 | |
| D. | 图④中的装置可形成持续稳定的电流.将锌片浸入CuSO4溶液中发生的化学反应与图④中的原电池装置反应不相同 |
5.A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成.B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
下表为B与F实验的部分内容
写出B与稀H2SO4反应的离子方程式S2O32-+2H+=S↓+SO2↑+H2O
写出②中反应的化学方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl
(3)现由6种粒子Mn2+、MnO${\;}_{4}^{-}$、H+、H2O、X2Y${\;}_{8}^{2-}$(C中含有的阴离子),XY${\;}_{4}^{2-}$完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO${\;}_{4}^{-}$需氧化剂的物质的量为2.5mol
(4)化合物D和E相互转化D$?_{CO_{2}•H_{2}O}^{△}$ E,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为8.4g,E•xH2O的化学式为Na2C03•7H2O.
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
下表为B与F实验的部分内容
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出②中反应的化学方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl
(3)现由6种粒子Mn2+、MnO${\;}_{4}^{-}$、H+、H2O、X2Y${\;}_{8}^{2-}$(C中含有的阴离子),XY${\;}_{4}^{2-}$完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO${\;}_{4}^{-}$需氧化剂的物质的量为2.5mol
(4)化合物D和E相互转化D$?_{CO_{2}•H_{2}O}^{△}$ E,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为8.4g,E•xH2O的化学式为Na2C03•7H2O.
9.在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
| A. | Fe2S3、I2 | B. | FeS、S、Al(OH)3 | C. | Al(OH)3、I2 | D. | Fe(OH)3、Al(OH)3 |
3.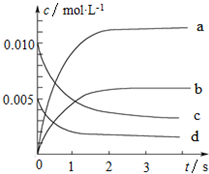 800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
(1)从0~3s内,用NO表示的平均反应速率v(NO)=2.17×10-3mol•L-1•s-1.
(2)图中表示NO浓度变化的曲线是c(填字母代号).
(3)达平衡时NO的转化率为65%.
(4)能说明该反应已达到平衡状态的是ACD(填序号).
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.v逆 (NO2)=2v正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向逆反应方向(填“正反应方向”“逆反应方向”)移动.
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为12.5akJ.
 800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.| 时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO浓度变化的曲线是c(填字母代号).
(3)达平衡时NO的转化率为65%.
(4)能说明该反应已达到平衡状态的是ACD(填序号).
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.v逆 (NO2)=2v正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向逆反应方向(填“正反应方向”“逆反应方向”)移动.
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为12.5akJ.
4.一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍.该混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了8.4g,该混合气体可能是( )
| A. | 乙烷和乙烯 | B. | 乙烷和乙烯 | C. | 甲烷和乙烯 | D. | 甲烷和丙烯 |


 CH3COOCH2CH3+H2O,用饱和碳酸钠溶液(填药品名称) 收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和碳酸钠溶液(填药品名称) 收集粗产品,用分液(填操作名称)的方法把粗产品分离.