题目内容
13.氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等.回答以下问题:(1)N的基态原子中,有3个运动状态不同的未成对电子.
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是3d24s2.
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的是NH3,N2H4;不能作为配位体的是NH4+,N2H62+.
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是HN3分子间存在氢键.
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中氮原子的杂化类型是sp3.
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g),若该反应中有4mol N-H键断裂,则形成的π键有3mol.
(6)肼能与硫酸反应生成N2H6SO4.N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4 内微粒间作用力不存在d(填标号)
a、离子键 b、共价键 c、配位键 d、范德华力.
分析 (1)根据氮原子的轨道表示式来解答;
(2)某元素原子与N3-含有相同的电子数,则该元素的电子数为22,先写出基态原子的电子排布式,然后写出价电子排布式;
(3)氢键的形成原因是孤电子对与原子核之间的引力,这就要求另一个条件为原子核要小,所以一般为O,N,F原子,像NH3有一对孤电子对,N2H4有两对孤电子对,所以NH3、N2H4等能形成氢键,而NH4+、N2H62+ 中孤电子对都与H+离子共用,从而也就没有了孤电子对,没有孤电子对不能形成配位体;
(4)分子间氢键使物质的沸点升高;
(5)①根据分子中δ键数目与孤电子对数目判断;
②反应中有4mol N-H键断裂,生成1.5molN2,根据结构式N≡N判断;
③N2H6SO4晶体类型与硫酸铵相同,应含有配位键、离子键和共价键.
解答 解:(1)氮原子能量最低排布是: ,有3个运动状态不同的未成对电子,
,有3个运动状态不同的未成对电子,
故答案为:3;
(2)某元素原子的电子数为22,该元素基态原子的电子排布式为:1s22s22p63s23p63d24s2,价电子排布式为:3d24s2,
故答案为:3d24s2;
(3)氢键的形成原因是孤电子对与原子核之间的引力,这就要求另一个条件为原子核要小,所以一般为O,N,F原子,像NH3有一对孤电子对,N2H4有两对孤电子对.所以NH3,N2H4等能形成氢键,而NH4+,N2H62+ 中孤电子对都与H+离子共用,从而也就没有了孤电子对;不能作为配位体的有NH4+,N2H62+,
故答案为:NH3,N2H4;NH4+,N2H62+.
(4)HN3分子间存在氢键,大大增加了分子间作用力,所以HN3在常温下是一种液体,沸点较高,
故答案为:HN3分子间存在氢键;
(5)①由于N2H4分子中N原子形成3个δ键,且有1个孤电子对,N原子sp3杂化,
故答案为:sp3;
②N2O4+2N2H4═3N2+4H2O,若该反应中有4mol N-H键断裂,即有1mol N2H4参加反应,生成1.5mol N2,形成π键的物质的量为2×1.5mol=3mol,
故答案为:3;
(6)③肼与硫酸反应的离子方程式为N2H4+2H+═N2H62+,N2H6SO4晶体类型与硫酸铵相同,N2H62+中的化学键是共价键与配位键,N2H62+与SO42-之间是离子键,不存在范德华力,
故答案为:d.
点评 本题考查考查较为综合,涉及核外电子排布、杂化类型、配位键等知识,综合考查学生的分析能力和基本概念的综合运用能力,注意掌握原子轨道杂化方式及判断方法,明确核外电子排布规律,难度中等.

| A. | 标准状况下,2.24 L CCl4中含氯原子数目为0.4NA | |
| B. | 1 mol羟基(-OH)中含电子的数目为10NA | |
| C. | 1mol苯乙烯( )中含碳碳双键数为4NA )中含碳碳双键数为4NA | |
| D. | 2.8g乙烯和环丙烷的混合气体中含原子总数为0.6NA |
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为4NA个 | |
| D. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA |
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0s~10s、10s~20s、20s~30s、30s~40s…)为40s~50s,可能原因是反应放热.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.氨水 B.CuCl2溶液 C.NaCl溶液 D.KNO3溶液
你认为他上述做法中可行的是C(填相应字母);
(4)另有某温度时,在2L容器中X、Y、Z物质的量随时间的变化关系曲线如下图1所示,该反应的化学方程式为:3X+Y?2Z.
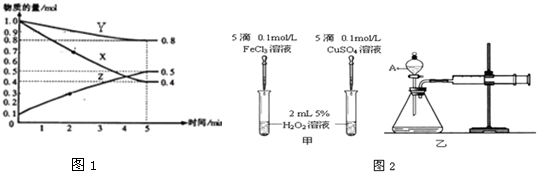
(5)在化学反应速率的学习中,某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图2甲可通过观察生成气泡的快慢判断,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子不同造成的干扰.
②定量分析:如图2乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是收集40mL气体所需要的时间.
 如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )| A. | 反应前后左室的压强相同 | |
| B. | 开始时左右两室中的分子数相同 | |
| C. | 反应后容器内的密度与反应前的相同 | |
| D. | 反应后容器内无O2存在 |
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
(2)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(3)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(4)下列有关该实验的叙述正确的是C、D.
A.实验时不能用量筒来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(5)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
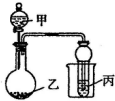 用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是( )
用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是( )| 选项 | 甲 | 乙 | 丙 | 试管中现象 | 结论 |
| A | 饱和食盐水 | 电石 | 酸性 KMnO4溶液 | 紫色褪去 | 乙炔发生氧化反应 |
| B | 稀盐酸 | 碳酸钠 | 澄清石灰水 | 溶液变浑浊 | 非金属性 Cl>C |
| C | 醋酸 | 碳酸钠 | 澄清石灰水 | 变浑浊 | 醋酸酸性强于碳酸 |
| D | 浓氨水 | 生石灰 | CuSO4溶液 | 蓝色略变深 | NH3与 CuSO4溶液不反应 |
| A. | A | B. | B | C. | C | D. | D |