题目内容
17.设NA为阿伏加徳罗常数的值.下列叙述不正确的是( )| A. | 标准状况下,22.4 LHF中所含共价键数目为NA | |
| B. | 已知某FeCl3溶液中Fe3+的物质的量为1 mol,则Cl-的数目大于3NA | |
| C. | 100 g含氢元素质量分数为12%的乙烯和乙醛(C2H4O)的混合物中,所含氧原子数目为NA | |
| D. | 在一定条件下,0.2mol NH3充分分解,生成N2的物质的量小于0.1mol |
分析 A、标况下HF为液体;
B、铁离子是弱碱阳离子,在溶液中会水解;
C、乙烯和乙醛(C2H4O)中C原子和H原子的个数之比均为1:2,根据H元素的质量分数求出H原子的物质的量,从而得出C原子的物质的量和质量,根据总质量即可求出混合物中含有的氧原子的质量和物质的量;
D、氨气的分解反应为可逆反应.
解答 解:A、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、铁离子是弱碱阳离子,在溶液中会水解,故当铁离子的物质的量为1mol时,溶液中氯离子的物质的量大于3mol,个数大于3NA个,故B正确;
C、由于H元素的质量分数为12%,故混合物中H原子的质量m=100g×12%=12g,则物质的量n=$\frac{12g}{1g/mol}$=12mol,而乙烯和乙醛(C2H4O)中C原子和H原子的个数之比均为1:2,故混合物中C原子的物质的量为6mol,质量为6mol×12g/mol=72g,则混合物中含有的氧原子的质量m=100g-12g-72g=16g,氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,个数为NA个,故C正确;
D、氨气的分解反应为可逆反应,不能进行彻底,故生成的氮气的物质的量小于0.1mol,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 熔融状态下能导电的物质一定是离子化合物 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 完全由非金属元素形成的化合物中可能含有离子键 |
5. 化学上常用AG表示溶液中的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.25℃时,用0.100mol•L-1的NaOH溶液滴定20.00mL 0.100mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
化学上常用AG表示溶液中的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.25℃时,用0.100mol•L-1的NaOH溶液滴定20.00mL 0.100mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
 化学上常用AG表示溶液中的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.25℃时,用0.100mol•L-1的NaOH溶液滴定20.00mL 0.100mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
化学上常用AG表示溶液中的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.25℃时,用0.100mol•L-1的NaOH溶液滴定20.00mL 0.100mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A. | D点溶液的pH=11.25 | |
| B. | B点溶液中存在 c(H+ )-c(OH- )=c(NO2- )-c(HNO2) | |
| C. | C点时,加入NaOH溶液的体积为20 mL | |
| D. | 25℃时,HNO2的电离常数Ka=1.0×10-55 |
12.下列实验现象正确且实验操作能达到实验目的是( )
| 实验操作 | 实验现象 | 实验目的 | |
| A | 向待测液中滴加盐酸和稀硝酸 | 产生白色沉淀 | 检验待测液中是否含有Ag+ |
| B | 将含有少量CO2的CO气体緩缓通过足量的 过氧化钠粉末 | 淡黄色粉末变白 | 除去CO2,提纯CO |
| C | 在Na2S溶液中滴加新制氯水 | 产生浅黄色沉淀 | 证明氯的非金属性比硫的强 |
| D | 在Ag2S浊液中滴加NaCl溶液 | 产生白色沉淀 | 比较Ag2S和AgCl的溶解度大小 |
| A. | A | B. | B | C. | C | D. | D |
2.关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )
| A. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| B. | 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子 | |
| C. | 2H2O2(l)=2H2O(l)+O2(g)△H=-98.2 kJ/mol,△S=70.5 J/(mol•K),该反应低温能自发进行 | |
| D. | 向含有NH4+、Ba2+、Cl-、NO3-离子的溶液中加入少量过氧化钠,以上各离子量几乎不减少 |
9.有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是( )

| A. | X与Z形成的某种化合物可用来杀菌消毒 | |
| B. | C极易溶于B中,溶液呈碱性 | |
| C. | Y与Z形成的二元化合物只含有极性键 | |
| D. | A和C能发生氧化还原反应 |
6. 国家食品药品监督管理总局批准了抗H7N9流感药帕拉米韦氯化钠注射液,其结构如图所示.下列关于帕拉米韦的说法正确的是( )
国家食品药品监督管理总局批准了抗H7N9流感药帕拉米韦氯化钠注射液,其结构如图所示.下列关于帕拉米韦的说法正确的是( )
 国家食品药品监督管理总局批准了抗H7N9流感药帕拉米韦氯化钠注射液,其结构如图所示.下列关于帕拉米韦的说法正确的是( )
国家食品药品监督管理总局批准了抗H7N9流感药帕拉米韦氯化钠注射液,其结构如图所示.下列关于帕拉米韦的说法正确的是( )| A. | 帕拉米韦的分子式为C15H27N4O4 | |
| B. | 1 mol帕拉米韦最多可以与3 mol NaOH发生反应 | |
| C. | 帕拉米韦分子中有6个手性碳原子 | |
| D. | 帕拉米韦能发生取代、消去和氧化反应 |
20.化学与社会,生活、生产密切相关,下列有关叙述正确的是( )
| A. | 蛋白质、棉花、淀粉、油脂都是由高分子构成的物质 | |
| B. | 绿色化学的核心是在化学合成中将原子充分利用,转化为新的原子 | |
| C. | 新装修的房子释放的甲醛为环境污染物,危害人体健康 | |
| D. | 亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制 |
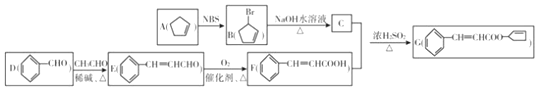
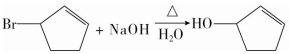 ,其反应类型为取代反应(或水解反应).
,其反应类型为取代反应(或水解反应).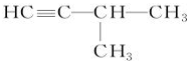 .
.