题目内容
 I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是
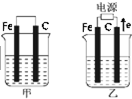
I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是Ⅱ.甲、乙两池的电极材料都是铁棒与碳棒(如图).请回答下列问题:
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的
②在乙池中碳棒一极的电极反应式是
(2)若两池中均盛放饱和NaCl溶液,反应一段时间后:
①写出乙池中发生的总反应的离子方程式
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化.若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,溶液后的pH=
考点:化学电源新型电池
专题:电化学专题
分析:I.(1)燃料电池中燃料在负极失电子;
Ⅱ.(1)甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电;
(2)①电解NaCl溶液生成NaOH、氢气、氯气;
②在水溶液里,氯气能将碘氧化生成盐酸和碘酸;
③乙池转移0.02mole-,由2e-~2NaOH计算.
Ⅱ.(1)甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电;
(2)①电解NaCl溶液生成NaOH、氢气、氯气;
②在水溶液里,氯气能将碘氧化生成盐酸和碘酸;
③乙池转移0.02mole-,由2e-~2NaOH计算.
解答:
解:I.(1)燃料电池中燃料在负极失电子,则碱性条件下,C2H6失电子生成碳酸根离子,其电极方程式为:C2H6-14e-+18OH-=2CO32-+12H2O;
故答案为:C2H6-14e-+18OH-=2CO32-+12H2O;
Ⅱ.(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,故答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
②乙池碳棒附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O═2HIO3+10HCl;
③乙池转移0.02mole-,由2e-~2NaOH可知,n(NaOH)=0.02mol,c(NaOH)=
=0.1mol/L,所以pH=13,
故答案为:13.
故答案为:C2H6-14e-+18OH-=2CO32-+12H2O;
Ⅱ.(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,故答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
②乙池碳棒附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O═2HIO3+10HCl;
③乙池转移0.02mole-,由2e-~2NaOH可知,n(NaOH)=0.02mol,c(NaOH)=
| 0.02mol |
| 0.2L |
故答案为:13.
点评:本题考查原电池和电解原理,明确工作原理及发生的电极反应是解答的关键,注意电极的判断和电子守恒的应用,题目难度中等.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
| B、用惰性电极电解饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ |
| C、向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| D、Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
将0.48g Mg粉加入到500mL 0.1mol/L的硝酸中恰好完全反应,则还原产物可能是( )
| A、NO2 |
| B、NO |
| C、N2O3 |
| D、NH4+ |