题目内容
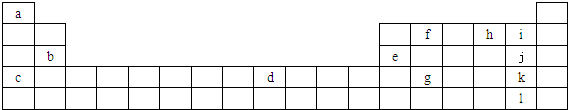
下表列出了①~⑩十种元素在周期表中的位置:
(1)上述①~⑩十种元素中(用元素符号填空):
构成有机物的主要元素是 ,构成岩石与许多矿物的基本元素是 ,
化学性质最不活泼的元素 ,气态氢化物的水溶液呈碱性的元素 .
(2)上述①~⑨元素的最高价氧化物对应的水化物中:
碱性最强的物质的电子式为 ,酸性最强的物质的化学式为 .
(3)若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作 极(填“正”或“负”)
(4)元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体.若这两种气体混合,会生成一种淡黄色粉末.此反应化学方程式为 .若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为 (填数值).
(5)元素⑧和元素⑨两者核电荷数之差是 ,这两种元素中非金属性较弱的元素是 (填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示) .
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑩ | |
| 4 | ⑨ |
构成有机物的主要元素是
化学性质最不活泼的元素
(2)上述①~⑨元素的最高价氧化物对应的水化物中:
碱性最强的物质的电子式为
(3)若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作
(4)元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体.若这两种气体混合,会生成一种淡黄色粉末.此反应化学方程式为
(5)元素⑧和元素⑨两者核电荷数之差是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,①为C、②为N、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Br、⑩为Ar.
(1)构成有机物的主要元素是碳,构成岩石与许多矿物的基本元素是硅,化学性质最不活泼的元素稀有气体,气态氢化物的水溶液呈碱性的元素是氮;
(2)上述①~⑨元素的最高价氧化物对应的水化物中:碱性最强的物质为氢氧化钠,酸性最强的物质为高氯酸;
(3)Mg、Al为电极,与NaOH为溶液构成原电池,反应本质是Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,故Al为负极、Mg为正极;
(4)二氧化硫与硫化氢反应生成S与水;反应中S为氧化产物、还原产物,根据方程式判断二者质量之比,进而计算生成S的总质量,计算硫化氢的物质的量,结合硫化氢中S元素化合价变化计算转移电子数目;
(5)元素⑧和元素⑨同主族,处于过渡元素之后,二者原子序数相差元素⑨所在周期容纳元素种数;同主族自上而下非金属性减弱,可以利用元素单质之间的相互置换反应说明元素非金属性强弱.
(1)构成有机物的主要元素是碳,构成岩石与许多矿物的基本元素是硅,化学性质最不活泼的元素稀有气体,气态氢化物的水溶液呈碱性的元素是氮;
(2)上述①~⑨元素的最高价氧化物对应的水化物中:碱性最强的物质为氢氧化钠,酸性最强的物质为高氯酸;
(3)Mg、Al为电极,与NaOH为溶液构成原电池,反应本质是Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,故Al为负极、Mg为正极;
(4)二氧化硫与硫化氢反应生成S与水;反应中S为氧化产物、还原产物,根据方程式判断二者质量之比,进而计算生成S的总质量,计算硫化氢的物质的量,结合硫化氢中S元素化合价变化计算转移电子数目;
(5)元素⑧和元素⑨同主族,处于过渡元素之后,二者原子序数相差元素⑨所在周期容纳元素种数;同主族自上而下非金属性减弱,可以利用元素单质之间的相互置换反应说明元素非金属性强弱.
解答:
解:由元素在周期表中的位置可知,①为C、②为N、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Br、⑩为Ar.
(1)构成有机物的主要元素是碳,构成岩石与许多矿物的基本元素是硅,化学性质最不活泼的元素稀有气体Ar,气态氢化物的水溶液呈碱性的元素是氮,
故答案为:C;Si;Ar;N;
(2)上述①~⑨元素的最高价氧化物对应的水化物中:碱性最强的物质为氢氧化钠,其电子式为: ,酸性最强的物质为高氯酸,化学式为:HClO4,
,酸性最强的物质为高氯酸,化学式为:HClO4,
故答案为: ;HClO4;
;HClO4;
(3)Mg、Al为电极,与NaOH为溶液构成原电池,反应本质是Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,故Al为负极、Mg为正极,
故答案为:正;
(4)二氧化硫与硫化氢反应生成S与水,反应方程式为:2H2S+SO2=3S↓+H2O;反应中S为氧化产物、还原产物,质量之比为2:1,故生成S的总质量为3.2g÷
=4.8g,其物质的量=
=0.15mol,故参加反应硫化氢的物质的量为0.15mol×
=0.1mol,故转移电子数目=0.1mol×[0-(-2)]×6.02×1023mol-1=1.204×1023,
故答案为:2H2S+SO2=3S↓+H2O;1.204×1023;
(5)元素⑧和元素⑨同主族,处于过渡元素之后,二者原子序数相差元素⑨所在周期容纳元素种数,即原子序数相差18;同主族自上而下非金属性减弱,故非金属性Cl>Br,可以利用元素单质之间的相互置换反应说明元素非金属性强弱,离子方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:18;溴;Cl2+2Br-=2Cl-+Br2.
(1)构成有机物的主要元素是碳,构成岩石与许多矿物的基本元素是硅,化学性质最不活泼的元素稀有气体Ar,气态氢化物的水溶液呈碱性的元素是氮,
故答案为:C;Si;Ar;N;
(2)上述①~⑨元素的最高价氧化物对应的水化物中:碱性最强的物质为氢氧化钠,其电子式为:
 ,酸性最强的物质为高氯酸,化学式为:HClO4,
,酸性最强的物质为高氯酸,化学式为:HClO4,故答案为:
 ;HClO4;
;HClO4;(3)Mg、Al为电极,与NaOH为溶液构成原电池,反应本质是Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,故Al为负极、Mg为正极,
故答案为:正;
(4)二氧化硫与硫化氢反应生成S与水,反应方程式为:2H2S+SO2=3S↓+H2O;反应中S为氧化产物、还原产物,质量之比为2:1,故生成S的总质量为3.2g÷
| 2 |
| 3 |
| 4.8g |
| 32g/mol |
| 2 |
| 3 |
故答案为:2H2S+SO2=3S↓+H2O;1.204×1023;
(5)元素⑧和元素⑨同主族,处于过渡元素之后,二者原子序数相差元素⑨所在周期容纳元素种数,即原子序数相差18;同主族自上而下非金属性减弱,故非金属性Cl>Br,可以利用元素单质之间的相互置换反应说明元素非金属性强弱,离子方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:18;溴;Cl2+2Br-=2Cl-+Br2.
点评:本题考查元素周期律与元素周期表,难度不大,侧重对基础知识的巩固,需要学生熟练掌握基础知识,(3)中注意根据发生的反应判断电极.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、100℃时,纯水中c(H +)=1×10-6mol?L-1,此时纯水显酸性 | ||
| B、25℃时,pH=10的氨水与pH=4盐酸等体积混合,所得溶液呈酸性 | ||
| C、25℃时,将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则b=(a+1) | ||
D、25℃时,
|
 某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中O点代表氢元素.下列说法中正确的是( )| A、离0点越远的元素原子半径越大 |
| B、虚线相连的元素处于同一族 |
| C、B、C最高价氧化物的水化物不能相互反应 |
| D、A、B组成的化合物中不可能含有共价键 |
化学世界是个五彩缤纷的世界,下列关于颜色的变化叙述正确的是( )
| A、向盛有苯酚溶液的试管中滴入FeCl3溶液,溶液呈紫色 |
| B、淀粉溶液遇碘离子变蓝 |
| C、氨气能使湿润的蓝色石蕊试纸变红 |
| D、二氧化硫能使石蕊溶液变红后褪色 |
 硫元素有多种化合价,可形成多种化合物.
硫元素有多种化合价,可形成多种化合物. I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是
I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是