题目内容
有一处于平衡状态的反应:X(s)+3Y(g)?2Z(g)(正反应是放热反应).为了使平衡向生成Z的方向移动,应选择的条件是( )
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z.
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z.
| A、①③⑤ | B、②③⑤ |
| C、②③⑥ | D、②④⑥ |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:根据影响化学平衡移动的因素:升高温度、平衡向着吸热方向移动,降低温度,平衡向着放热方向移动;升高压强,平衡向着气体体积减小的方向移动,降低压强,平衡向气体体积增大的方向移动;增大反应物浓度或者减小生成物浓度平衡都向正方向移动;催化剂只改变反应速率不改变平衡移动.
解答:
解:反应X(g)+3Y(s)?2Z(g)(正反应是放热反应),是一个放热反应,所以升高温度,平衡逆向移动,降低温度,平衡正向移动,故①错误,②正确;增大压强,平衡向着气体体积减小的方向即逆向进行,减小压强,平衡正向移动,故③正确;④错误;加催化剂不会引起化学平衡的移动,故⑤错误;分离出Z,即减小生成物的浓度,平衡正向移动,故⑥正确.
故选C.
故选C.
点评:本题考查学生化学平衡移动原理知识,可以根据所学知识来回答,难度不大.

练习册系列答案
相关题目
有两种金属组成的混合物粉末32g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成可能是( )
①Fe、Zn ②Al、Cu ③Ag、Mg ④Al、Fe.
①Fe、Zn ②Al、Cu ③Ag、Mg ④Al、Fe.
| A、①②③④ | B、①②③ |
| C、①③ | D、②③④ |
“碧水千河扬长帆,蓝天白云飘纸鸢.草长莺飞千山绿,人与江山共画卷.”我们淮安市人民正在积极建设“碧水蓝天”的生态城市,下列措施中不合理的是( )
| A、限制化学工业发展,关停所有化工企业,消除污染源头 |
| B、积极推广太阳能、风能等新能源的使用,减少化石燃料的使用 |
| C、加强城市生活污水脱氮除磷处理,遏制水体富营养化 |
| D、禁止农村燃烧秸杆,积极推广沼气、秸秆发电、秸秆制乙醇等实用技术的使用 |
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol/L,Mg2+为0.5mol/L,则SO42-的物质的量浓度为( )
| A、0.1 mol/L |
| B、0.5 mol/L |
| C、0.15 mol/L |
| D、0.25 mol/L |
下列有关实验原理、装置、操作或结论的描述中,正确的是( )
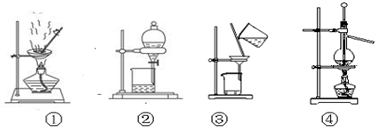

| A、用图①装置蒸发稀盐酸制浓盐酸 |
| B、用图②装置分液时,下层液体从分液漏斗下口放出,关闭活塞再将上层液体从上口倒出 |
| C、用图③洗涤沉淀时,漏斗中加入适量蒸馏水,搅拌并滤干 |
| D、用图④装置,分离四氯化碳与苯的混合溶液 |

