题目内容
1789年英国化学家台耐特(Smithson Tennant)把氯气溶解在石灰乳中,制成了漂白粉.此法在工业上沿用至今.回答下列问题:
(1)配平氯气通入消石灰制取漂白粉的反应:
Cl2+6Ca(OH)2= Ca(ClO)2+ CaCl2?2H2O
(2)实验证实,某批次的漂白粉的碱性明显大于正常情况下的漂白粉.原因是可能该批次的产品中混有较多的 (填写化学式)
(3)漂白粉的质量标准之一是它的“有效氯”的含量.“有效氯”为酸化漂白粉悬浮液释放的氯气占所取漂白粉样品的质量分数 QUOTE.写出用醋酸酸化漂白粉悬浮液的化学方程式 ,并计算上述漂白粉的理论“有效氯” ?
(4)测定漂白粉的有效氯原理如下:配制一定浓度的漂白粉悬浮液,加入过量的用盐酸酸化的淀粉碘化钾溶液后变蓝.再加入硫代硫酸钠(Na2S2O3)溶液,使蓝色恰好褪去(生成S4O62-).写出以上步骤涉及的离子方程式(漂白粉中涉及反应的成分写相应的离子).
(5)漂白粉放在空气中久置会变质,写出变质的化学方程式 .
(1)配平氯气通入消石灰制取漂白粉的反应:
(2)实验证实,某批次的漂白粉的碱性明显大于正常情况下的漂白粉.原因是可能该批次的产品中混有较多的
(3)漂白粉的质量标准之一是它的“有效氯”的含量.“有效氯”为酸化漂白粉悬浮液释放的氯气占所取漂白粉样品的质量分数 QUOTE.写出用醋酸酸化漂白粉悬浮液的化学方程式
(4)测定漂白粉的有效氯原理如下:配制一定浓度的漂白粉悬浮液,加入过量的用盐酸酸化的淀粉碘化钾溶液后变蓝.再加入硫代硫酸钠(Na2S2O3)溶液,使蓝色恰好褪去(生成S4O62-).写出以上步骤涉及的离子方程式(漂白粉中涉及反应的成分写相应的离子).
(5)漂白粉放在空气中久置会变质,写出变质的化学方程式
考点:氯气的化学性质,化学方程式的有关计算,氯、溴、碘及其化合物的综合应用
专题:计算题,卤族元素
分析:(1)由原子守恒配平化学反应;
(2)漂白粉的碱性明显大于正常情况下的漂白粉,则可能含Ca(OH)2;
(3)用醋酸酸化漂白粉,发生氧化还原反应生成氯气,.“有效氯”为酸化漂白粉悬浮液释放的氯气占所取漂白粉样品的质量分数,以此计算;
(4)漂白粉悬浮液,加入过量的用盐酸酸化的淀粉碘化钾溶液后变蓝,发生氧化还原反应生成碘;再加入硫代硫酸钠(Na2S2O3)溶液,使蓝色恰好褪去,与碘发生样还原反应;
(5)漂白粉放在空气中久置会变质,先与水、二氧化碳反应生成HClO,然后HClO分解.
(2)漂白粉的碱性明显大于正常情况下的漂白粉,则可能含Ca(OH)2;
(3)用醋酸酸化漂白粉,发生氧化还原反应生成氯气,.“有效氯”为酸化漂白粉悬浮液释放的氯气占所取漂白粉样品的质量分数,以此计算;
(4)漂白粉悬浮液,加入过量的用盐酸酸化的淀粉碘化钾溶液后变蓝,发生氧化还原反应生成碘;再加入硫代硫酸钠(Na2S2O3)溶液,使蓝色恰好褪去,与碘发生样还原反应;
(5)漂白粉放在空气中久置会变质,先与水、二氧化碳反应生成HClO,然后HClO分解.
解答:
解:(1)由原子守恒可知化学反应为6Cl2+6 Ca(OH)2=3Ca(ClO)2+3CaCl2?2H2O,故答案为:6;3;3;
(2)漂白粉的碱性明显大于正常情况下的漂白粉,则可能含Ca(OH)2,故答案为:Ca(OH)2;
(3)用醋酸酸化漂白粉,发生氧化还原反应生成氯气,反应为【Ca(ClO)2+CaCl2?2H2O】+4CH3COOH=2Cl2↑+2Ca(CH3COO)2+4H2O;“有效氯”为酸化漂白粉悬浊液释放的氯气占所取漂白粉样品的质量分数,由反应可知,生成142g氯气需要漂白粉样品的质量为(40+103)+(111+36)=290g,则“有效氯”为
×100%=48.97%,
故答案为:【Ca(ClO)2+CaCl2?2H2O】+4CH3COOH=2Cl2↑+2Ca(CH3COO)2+4H2O;48.97%;
(4)漂白粉悬浮液,加入过量的用盐酸酸化的淀粉碘化钾溶液后变蓝,发生氧化还原反应生成碘,离子反应为ClO-+2I-+2H+=Cl-+I2+H2O;再加入硫代硫酸钠(Na2S2O3)溶液,使蓝色恰好褪去,与碘发生样还原反应,离子反应为I2+2S2O32-=2I-+S4O62-,
故答案为:ClO-+2I-+2H+=Cl-+I2+H2O、I2+2S2O32-=2I-+S4O62-;
(5)漂白粉放在空气中久置会变质,先与水、二氧化碳反应生成HClO,然后HClO分解,发生的反应为Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO、2HClO
=2HCl+O2↑,故答案为:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO、2HClO
=2HCl+O2↑.
(2)漂白粉的碱性明显大于正常情况下的漂白粉,则可能含Ca(OH)2,故答案为:Ca(OH)2;
(3)用醋酸酸化漂白粉,发生氧化还原反应生成氯气,反应为【Ca(ClO)2+CaCl2?2H2O】+4CH3COOH=2Cl2↑+2Ca(CH3COO)2+4H2O;“有效氯”为酸化漂白粉悬浊液释放的氯气占所取漂白粉样品的质量分数,由反应可知,生成142g氯气需要漂白粉样品的质量为(40+103)+(111+36)=290g,则“有效氯”为
| 142g |
| 290g |
故答案为:【Ca(ClO)2+CaCl2?2H2O】+4CH3COOH=2Cl2↑+2Ca(CH3COO)2+4H2O;48.97%;
(4)漂白粉悬浮液,加入过量的用盐酸酸化的淀粉碘化钾溶液后变蓝,发生氧化还原反应生成碘,离子反应为ClO-+2I-+2H+=Cl-+I2+H2O;再加入硫代硫酸钠(Na2S2O3)溶液,使蓝色恰好褪去,与碘发生样还原反应,离子反应为I2+2S2O32-=2I-+S4O62-,
故答案为:ClO-+2I-+2H+=Cl-+I2+H2O、I2+2S2O32-=2I-+S4O62-;
(5)漂白粉放在空气中久置会变质,先与水、二氧化碳反应生成HClO,然后HClO分解,发生的反应为Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO、2HClO
| ||
| ||
点评:本题考查氯气的性质,涉及化学反应书写、离子反应的书写及计算等,侧重分析与应用能力的综合考查,注重知识的迁移应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列溶液中,溶质的物质的量浓度为1mol?L-1的是( )
| A、将40g NaOH溶于1L水所得的溶液 |
| B、将0.5mol?L-1的NaNO3溶液100mL加热蒸发掉50g水所得的溶液 |
| C、将23g Na溶于水并配成1L的溶液 |
| D、从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L |
下列关于有机物的说法不正确的是( )
| A、鸡蛋清溶液中加入饱和Na2SO4溶液,有沉淀产生,再加入大量水,沉淀不溶解 |
| B、乙醇溶液常用于医疗消毒是因为它能使细菌蛋白体发生变性 |
| C、在临床上解救误服重金属盐中毒的病人时,常要求病人服用大量牛奶或豆浆 |
| D、皮肤、指甲不慎沾上浓硝酸会出现黄色 |
相同温度下,等体积的两个集气瓶分别盛
C,
N,
O三种原子构成的CO和N2下列说法正确的是( )
12 6 |
14 7 |
18 8 |
| A、质量和分子数相同 |
| B、若压强相同,则含有相同的质子数,但质量不同 |
| C、质量和分子数都不相同 |
| D、若压强相同,则含有相同的原子、质子、中子和电子 |

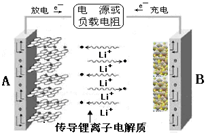 锂离子电池是具有电压高、能量密度大、循环性能好等突出优点的高效绿色产品.某锂离子电池的结构如右图所示,以石墨化的碳、氧化钴锂(LiCoO2)为电极,当充电时,阳极上发生的电极反应为LiCoO2-xe-=Li1-xCoO2+xLi+,总反应式为LiCoO2+6C=Li1-xCoO2+LixC6.
锂离子电池是具有电压高、能量密度大、循环性能好等突出优点的高效绿色产品.某锂离子电池的结构如右图所示,以石墨化的碳、氧化钴锂(LiCoO2)为电极,当充电时,阳极上发生的电极反应为LiCoO2-xe-=Li1-xCoO2+xLi+,总反应式为LiCoO2+6C=Li1-xCoO2+LixC6.