题目内容
14.工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下: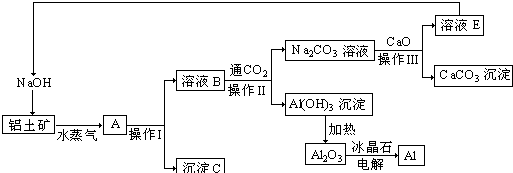
请回答下列问题:
(1)水蒸气的作用加热加快反应;
(2)沉淀C的化学式为Fe2O3,该物质除了用于金属冶炼以外,还可用作颜料(或炼铁);
(3)操作I、操作II、操作III都用到的玻璃仪器是有烧杯、漏斗、玻璃棒;
(4)写出制备过程中由溶液B生成Al(OH)3的离子方程式2AlO2-+CO2+3H2O═2Al(OH)3+CO32-;
(5)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有CaO和CO2(填化学式).用此法制取铝的副产品是Fe2O3和O2(填化学式).
分析 铝土矿的成分为氧化铝、氧化铁,由制备Al的流程可知,NaOH与Al2O3反应,而Fe2O3不能,则利于水蒸气加快反应速率,操作I为过滤,得到沉淀C为Fe2O3,溶液B中含NaOH、NaAlO2,通入二氧化碳发生2AlO2-+CO2+3H2O═2 Al(OH)3+CO32-,操作Ⅱ为过滤,碳酸钠溶液与CaO反应生成碳酸钙沉淀和NaOH,操作Ⅲ为过滤,溶液E中含NaOH,NaOH可循环使用,氢氧化铝加热分解生成氧化铝,电解氧化铝生成Al、氧气,以此来解答.
解答 解:铝土矿的成分为氧化铝、氧化铁,由制备Al的流程可知,NaOH与Al2O3反应,而Fe2O3不能,则利于水蒸气加快反应速率,操作I为过滤,得到沉淀C为Fe2O3,溶液B中含NaOH、NaAlO2,通入二氧化碳发生2AlO2-+CO2+3H2O═2 Al(OH)3+CO32-,操作Ⅱ为过滤,碳酸钠溶液与CaO反应生成碳酸钙沉淀和NaOH,操作Ⅲ为过滤,溶液E中含NaOH,NaOH可循环使用,氢氧化铝加热分解生成氧化铝,电解氧化铝生成Al、氧气,
(1)水蒸气的作用为加热加快反应,故答案为:加热加快反应;
(2)由上述分析可知,沉淀C的化学式为Fe2O3,该物质除了用于金属冶炼以外,还可用作颜料(或炼铁),故答案为:Fe2O3;颜料(或炼铁);
(3)操作I、操作II、操作III均为过滤,都用到的玻璃仪器是有烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(4)由溶液B生成Al(OH)3的离子方程式为2AlO2-+CO2+3H2O═2 Al(OH)3+CO32-,故答案为:2AlO2-+CO2+3H2O═2 Al(OH)3+CO32-;
(5)碳酸钙可分解生成CaO和CO2,在上述流程中均可循环使用,用此法制取铝的副产品是Fe2O3和O2,故答案为:CaO和CO2;Fe2O3和O2.
点评 本题考查物质的制备实验及混合物分离提纯的综合应用,为高频考点,把握流程中的反应、混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物与实验的结合,题目难度不大.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
下列说法正确的是( )
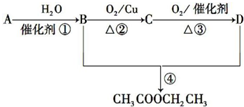
| A. | 溶液X中存在大量Mg2+ | |
| B. | 溶液X中一定存在K+ | |
| C. | 溶液X中c(CO32-)=0.02mol•L-1 | |
| D. | 溶液X中一定存在NH4+、Cl-、CO32-、SO42- |
| A. | ①②③④⑤ | B. | ②③④ | C. | ②④⑤⑥ | D. | ①②④ |
| A. | 用肥皂洗涤久置石灰水的试剂瓶 | B. | 用酒精清洗残留碘的试管 | ||
| C. | 用洗涤剂清洗餐具上的油污 | D. | 用汽油清洗沾在手上的油漆 |
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ 其热化学方程式为:N2(g)+3H2(g)$?_{500℃/30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则1mol稀H2SO4和足量KOH反应的反应热为△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件的△H不同 |
| A. | 乙醇 | B. | 乙酸 | C. | 乙烷 | D. | 乙烯 |
| A. | 若a<b,则c(OH-)<c(H+) | B. | 若a>b,则c(NH4+)>c(Cl-) | ||
| C. | 若a>b,则c(OH-)>c(H+) | D. | 若a=b,则c(NH4+)=c(Cl-) |
 已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.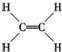 .
.