题目内容
实验室用锌跟足量的稀硫酸反应制取氢气,若要制得2.24L(标准状况)氢气,需要 mol锌,同时要消耗1mol/L的硫酸 mL.
考点:化学方程式的有关计算
专题:计算题
分析:发生反应:Zn+H2SO4═ZnSO4+H2↑,根据n=
计算氢气的物质的量,根据方程式定比关系计算参加反应的Zn、消耗的H2SO4的物质的量,再根据V=
计算消耗稀硫酸的体积.
| V |
| Vm |
| n |
| c |
解答:
解:标况下,2.24L氢气的物质的量为
=0.1mol,
设需要Zn的物质的量为x,消耗的H2SO4的物质的量为y,则:
Zn+H2SO4═ZnSO4+H2↑
1 1 1
x y 0.1mol
1mol:1mol=x:0.1mol 解得:x=0.1mol
1mol:1mol=y:0.1mol 解得:y=0.1mol
故需要消耗1mol/L的硫酸的体积为
=0.1L=100mL,
故答案为:0.1;100.
| 2.24L |
| 22.4L/mol |
设需要Zn的物质的量为x,消耗的H2SO4的物质的量为y,则:
Zn+H2SO4═ZnSO4+H2↑
1 1 1
x y 0.1mol
1mol:1mol=x:0.1mol 解得:x=0.1mol
1mol:1mol=y:0.1mol 解得:y=0.1mol
故需要消耗1mol/L的硫酸的体积为
| 0.1mol |
| 1mol/L |
故答案为:0.1;100.
点评:本题考查化学方程式的有关计算,比较基础,注意掌握根据方程式计算格式,侧重对基础知识的巩固.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、过氧化钠和冷水反应:Na2O2+H2O═2Na++2OH-+H2↑ |
| B、NaHCO3溶于氢氧化钠溶液:HCO3-+OH-=H2O+CO2↑ |
| C、金属铝溶于稀硫酸中:2Al+6H+═2Al3++3H2↑ |
| D、铜跟稀硫酸反应:Cu+2H+═Cu2++H2↑ |
下列实验与对应示意图的关系正确的是( )
A、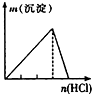 NaAlO2溶液中逐滴滴加稀盐酸至过量 |
B、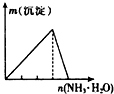 AlCl3溶液中逐滴滴加氨水至过量 |
C、 明矾溶液中逐滴滴加Ba(OH)2至过量 |
D、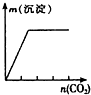 澄清石灰水中缓慢通入CO2至过量 |