题目内容
I.请指出下列过程需要破坏的作用力
①离子键 ②极性共价键③非极性共价键④氢键⑤分子间作用力
(1)干冰熔化 ;(填序号,下同)
(2)氢氧化钠溶于水 ;
(3)过氧化钠溶于水 ;
(4)氯化氢气体溶于水 ;
(5)冰熔化 ;
Ⅱ.写出下列物质的电子式:
(1)N2 (2)Na2O2 (3)NH4Cl (4)MgF2 (5)CO2 .
①离子键 ②极性共价键③非极性共价键④氢键⑤分子间作用力
(1)干冰熔化
(2)氢氧化钠溶于水
(3)过氧化钠溶于水
(4)氯化氢气体溶于水
(5)冰熔化
Ⅱ.写出下列物质的电子式:
(1)N2
考点:化学键和分子间作用力的区别,电子式
专题:
分析:I.(1)干冰熔化是分子晶体,熔化属于物理变化,需要破坏分子间作用力;
(2)氢氧化钠是离子化合物,溶于水发生电离生成钠离子和氢氧根离子,破坏离子键;
(3)过氧化钠是含有离子键和非极性共价键的离子化合物,溶于水生成氢氧化钠和氧气,需要破坏离子键和非极性共价键;
(4)氯化氢气体含有极性共价键H-Cl键,溶于水发生电离,破坏了极性共价键;
(5)冰属于分子晶体,分子间含有氢键和分子间作用力,熔化时需要破坏氢键和分子间作用力;
Ⅱ.(1)氮气中存在3对共用电子对,氮原子最外层达到8个电子;
(2)过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
(3)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起,N与H以共价键相结合;
(4)MgF2属于离子化合物,1个镁离子与2个氟离子通过离子键结合形成氟化镁
(5)二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子.
(2)氢氧化钠是离子化合物,溶于水发生电离生成钠离子和氢氧根离子,破坏离子键;
(3)过氧化钠是含有离子键和非极性共价键的离子化合物,溶于水生成氢氧化钠和氧气,需要破坏离子键和非极性共价键;
(4)氯化氢气体含有极性共价键H-Cl键,溶于水发生电离,破坏了极性共价键;
(5)冰属于分子晶体,分子间含有氢键和分子间作用力,熔化时需要破坏氢键和分子间作用力;
Ⅱ.(1)氮气中存在3对共用电子对,氮原子最外层达到8个电子;
(2)过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
(3)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起,N与H以共价键相结合;
(4)MgF2属于离子化合物,1个镁离子与2个氟离子通过离子键结合形成氟化镁
(5)二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子.
解答:
解:I.(1)干冰熔化是分子晶体,熔化属于物理变化,需要破坏分子间作用力,
故答案为:⑤;
(2)氢氧化钠是离子化合物,溶于水发生电离生成钠离子和氢氧根离子,破坏离子键,
故答案为:①;
(3)过氧化钠是含有离子键和非极性共价键的离子化合物,溶于水生成氢氧化钠和氧气,需要破坏离子键和非极性共价键,
故答案为:①③;
(4)氯化氢气体含有极性共价键H-Cl键,溶于水发生电离,破坏了极性共价键,
故答案为:②;
(5)冰属于分子晶体,分子间含有氢键和分子间作用力,熔化时需要破坏氢键和分子间作用力,
故答案为:④⑤;
Ⅱ.(1)氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,
,
故答案为: ;
;
(2)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,
,
故答案为: ;
;
(3)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,
,
故答案为: ;
;
(4)镁原子失去2个电子形成镁离子,氟原子得到1个电子形成氟离子,1个镁离子与2个氟离子通过离子键结合形成氟化镁,电子式为: ,故答案为:
,故答案为: ;
;
(5)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: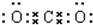 ,
,
故答案为: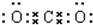 .
.
故答案为:⑤;
(2)氢氧化钠是离子化合物,溶于水发生电离生成钠离子和氢氧根离子,破坏离子键,
故答案为:①;
(3)过氧化钠是含有离子键和非极性共价键的离子化合物,溶于水生成氢氧化钠和氧气,需要破坏离子键和非极性共价键,
故答案为:①③;
(4)氯化氢气体含有极性共价键H-Cl键,溶于水发生电离,破坏了极性共价键,
故答案为:②;
(5)冰属于分子晶体,分子间含有氢键和分子间作用力,熔化时需要破坏氢键和分子间作用力,
故答案为:④⑤;
Ⅱ.(1)氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为
 ,
,故答案为:
 ;
;(2)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为
 ,
,故答案为:
 ;
;(3)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:
 ,
,故答案为:
 ;
;(4)镁原子失去2个电子形成镁离子,氟原子得到1个电子形成氟离子,1个镁离子与2个氟离子通过离子键结合形成氟化镁,电子式为:
 ,故答案为:
,故答案为: ;
;(5)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
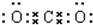 ,
,故答案为:
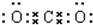 .
.
点评:本题考查了化学键、分子间作用力和氢键、电子式的书写,题目难度中等,注意掌握电子式的概念及正确的表示方法,明确离子化合物中阴离子需要标出最外层电子,阳离子直接用离子符号表示.

练习册系列答案
相关题目
可以用来鉴别丙烷和丙烯,还可以用来除去丙烷中丙烯的操作方法是( )
| A、将混合气体通过盛有高锰酸钾酸性溶液的洗气瓶 |
| B、将混合气体通过盛有适量溴水的洗气瓶 |
| C、将混合气体通过盛有苯的洗气瓶 |
| D、将混合气体通过盛有澄清石灰水的洗气瓶 |
硫酸的铁罐外口出现严重的腐蚀现象,这体现了浓硫酸的( )
| A、吸水性和酸性 |
| B、脱水性和吸水性 |
| C、强氧化性和吸水性 |
| D、不挥发性和酸性 |
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-71kJ/mol
②CO(g)+2H2(g)═CH3OH(l)△H=-90.5kJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol
不能得出的结论是( )
①2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-71kJ/mol
②CO(g)+2H2(g)═CH3OH(l)△H=-90.5kJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol
不能得出的结论是( )
| A、在以上三个反应中,都是反应物的总能量大于生成物的总能量 |
| B、CO(g)+2H2(g)═CH3OH(g)△H<-90.5 kJ/mol |
| C、甲醇的燃烧热△H=-764 kJ/mol |
| D、若CO的燃烧热△H=-283.0 kJ/mol,则H2的燃烧热△H=-286kJ/mol |
一个电子排布为1s22s22p63s23p1的元素最可能的价态是( )
| A、+1 | B、+2 | C、+3 | D、-1 |
