题目内容
在120℃时分别进行如下四个反应:
A.2H2S(气体)+O2=2H2O+2S↓
B. 2H2S(气体)+3O2=2H2O+2SO2
C.C2H4(气体)+3O2=2H2O+2CO2
D.C4H8(气体)+6O2=4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是 ;符合关系式d前=d后和p前=p后的是 (填写反应的序号).
(2)若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是 ;符合d前>d后和V前>V后的是 (填写反应的序号).
(3)一定温度和压强下,混合气体对氢气的相对密度为21,则C2H4和C4H8的体积比为 ,混合气体中C2H4的质量分数为 .
A.2H2S(气体)+O2=2H2O+2S↓
B. 2H2S(气体)+3O2=2H2O+2SO2
C.C2H4(气体)+3O2=2H2O+2CO2
D.C4H8(气体)+6O2=4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是
(2)若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是
(3)一定温度和压强下,混合气体对氢气的相对密度为21,则C2H4和C4H8的体积比为
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)反应前后气体密度不变,说明反应气体物质都是气体,p前>p后说明反应前后气体的物质的量减小;符合关系式d前=d后和p前=p后,说明反应前后的物质都是气体且反应前后气体的计量数之和不变;
(2)若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后,说明反应前后气体的计量数之和增大;
符合d前>d后和V前>V后说明反应前后气体的计量数之和减小,且气体质量减少;
(3)一定温度和压强下,混合气体对氢气的相对密度为21,混合气体的平均摩尔质量是42g/mol,利用平均摩尔质量计算气体体积之比,其质量分数之比.
(2)若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后,说明反应前后气体的计量数之和增大;
符合d前>d后和V前>V后说明反应前后气体的计量数之和减小,且气体质量减少;
(3)一定温度和压强下,混合气体对氢气的相对密度为21,混合气体的平均摩尔质量是42g/mol,利用平均摩尔质量计算气体体积之比,其质量分数之比.
解答:
解:(1)反应前后气体密度不变,说明反应气体物质都是气体,p前>p后说明反应前后气体的物质的量减小,故选B;符合关系式d前=d后和p前=p后,说明反应前后的物质都是气体且反应前后气体的计量数之和不变,故选C;
故答案为:B;C;
(2)若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后,说明反应前后气体的计量数之和增大,故选D;
符合d前>d后和V前>V后说明反应前后气体的计量数之和减小,且气体质量减少,故选A;
故答案为:D;A;
(3)一定温度和压强下,混合气体对氢气的相对密度为21,混合气体的平均摩尔质量是42g/mol,
设C2H4和C4H8的物质的量分别为xmol、ymol,
=42g/mol
x:y=1:1,
根据V=nVm知,相同条件下,气体体积之比等于其物质的量之比=1:1,
设两种气体都是1mol,乙烯是质量分数=
×100%=33.3%,
故答案为:1:1;33.3%.
故答案为:B;C;
(2)若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后,说明反应前后气体的计量数之和增大,故选D;
符合d前>d后和V前>V后说明反应前后气体的计量数之和减小,且气体质量减少,故选A;
故答案为:D;A;
(3)一定温度和压强下,混合气体对氢气的相对密度为21,混合气体的平均摩尔质量是42g/mol,
设C2H4和C4H8的物质的量分别为xmol、ymol,
| 28g/mol×xmol+56g/mol×ymol |
| (x+y)mol |
x:y=1:1,
根据V=nVm知,相同条件下,气体体积之比等于其物质的量之比=1:1,
设两种气体都是1mol,乙烯是质量分数=
| 28g/mol×1mol |
| (28g/mol+56g/mol)×1mol |
故答案为:1:1;33.3%.
点评:本题考查阿伏伽德罗定律及其推论,明确压强、体积与物质的量的关系是解本题关键,注意(1)、(2)题的区别,难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
下列反应与相应说法不正确的是( )
| A、SiO2+2NaOH═Na2SiO3+H2O说明SiO2是酸性氧化物 | ||||
B、SiO2+2C
| ||||
C、SiO2+Na2CO3
| ||||
| D、SiO2+4HF═SiF4↑+2H2O,说明了SiO2具有碱性 |
表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正确的是( )
| 元素代号 | X | Y | Z | W | N |
| 原子半径/nm | 0.186 | 0.074 | 0.102 | 0.099 | 0.160 |
| 主要化合价 | +1 | -2 | -2、+6 | +7、-1 | +2 |
| A、常温下单质与水反应速率:X>N |
| B、最高价氧化物对应水化物酸性:W>Z |
| C、X 与W形成的化合物是共价化合物 |
| D、X和Y的单质在一定条件下反应可生成一种淡黄色的固体化合物 |
0.5mol H2含有( )
| A、0.5 mol 个氢气分子 |
| B、6.02×1023个氢气分子 |
| C、3.01×1023个氢气分子 |
| D、3.01×1023个电子 |
如图是某学校实验室买回的硫酸试剂标签的部分内容.判断下列说法正确的是( )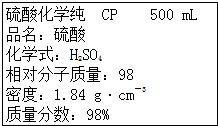

| A、该硫酸的浓度为9.2 mol?L-1 | ||
| B、配制200 mL 4.6 mol?L-1的稀H2SO4需该H2SO4 50 mL | ||
| C、该硫酸与等体积水混合质量分数变为49% | ||
D、取该硫酸100 mL,则浓度变为原来的
|
某气体的摩尔质量为M g?mol-1,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x.则
表示的是( )
| Mx |
| VNA |
| A、V L该气体的质量(以g为单位) |
| B、1 L该气体的质量(以g为单位) |
| C、1 mol该气体的体积(以L为单位) |
| D、1 L该气体中所含的分子数 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、lmol FeI2与足量氯气反应时转移的电子数为2NA | ||
B、室温下,14.0g分子通式为CnH2n烯烃中含有的碳碳双键数目为
| ||
| C、标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | ||
| D、氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |


 )也是医药工业的重要原料,下列有机物属 于水杨酸同系物的是
)也是医药工业的重要原料,下列有机物属 于水杨酸同系物的是