题目内容
19.下列实验操作、现象和结论均正确的是( )| 选项 | 实验操作 | 现象 | 结论 |
| A | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| B | 在KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变成蓝色 | KIO3的氧化性比I2强 |
| C | 向CH2=CHCH2OH中滴入酸性高锰酸钾溶液 | 紫红色褪去 | 证明CH2=CHCH2OH中含有碳碳双键 |
| D | 向Na2S溶液中加入酚酞,再滴加稀盐酸 | 溶液先变红,后红色变浅直至消失 | 证明非金属性:Cl>S |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Cu和稀硫酸不反应,酸性条件下硝酸根离子能和Cu发生氧化还原反应;
B.氧化剂的氧化性大于氧化产物的氧化性;
C.醇羟基和碳碳双键都能被酸性高锰酸钾溶液氧化;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据其氢化物水溶液酸性强弱判断非金属性强弱.
解答 解:A.Cu和稀硫酸不反应,酸性条件下硝酸根离子能和Cu发生氧化还原反应生成硝酸铜和NO,所以Cu溶解且生成气体,故A错误;
B.氧化剂的氧化性大于氧化产物的氧化性,淀粉试液变蓝色,说明碘酸钾和HI发生氧化还原反应生成碘,碘酸钾中I元素化合价由+5价变为0价、HI中I元素化合价由-1价变为0价,所以碘酸钾是氧化剂、碘是氧化产物,则氧化性KIO3>I2,故B正确;
C.醇羟基和碳碳双键都能被酸性高锰酸钾溶液氧化,所以不能用酸性高锰酸钾溶液检验碳碳双键,可以用溴水检验,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据其氢化物水溶液酸性强弱判断非金属性强弱,可以根据其单质的氧化性强弱判断非金属性强弱,所以该实验不能证明非金属性Cl>S,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及非金属性强弱判断、氧化性强弱比较、物质性质等知识点,侧重考查学生分析判断及实验评价能力,把握物质性质及实验原理是解本题关键,易错选项是A.

练习册系列答案
相关题目
19.等体积等物质的量浓度的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中有关离子浓度关系正确的是( )
| A. | C(M+)>C(OH-)>C(A-)>C(H+) | B. | C(M+)>C(A-)>C(H+)>C(OH-) | ||
| C. | C(M+)>C(A-)>C(OH-)>C(H+) | D. | C(M+)+C(H+)>C(A-)+C(OH-) |
14.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | Cl2的摩尔质量与NA个Cl2分子的质量在数值上相同 | |
| B. | 活泼金属从盐酸中置换出1mol H2,转移电子数为NA | |
| C. | 500mL 0.5mol•L-1Al2(SO4)3溶液中,含Al3+数目为0.5NA | |
| D. | 常温常压下,0.5 NA个一氧化碳分子所占体积是11.2L |
4.其它条件不变时仅升高温度,一定增大的是( )
| A. | 强碱在水中的溶解度 | B. | 吸热反应的热效应 | ||
| C. | 化学平衡常数K | D. | 盐类水解程度 |
11.下列叙述正确的是( )
| A. | pH=4的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释10000倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8 | |
| D. | 某温度下水的离子积为1.0×10-12,等体积的pH=1的H2SO4溶液与pH=11的NaOH溶液混合后溶液呈中性 |
8.日常生活中常用的净水剂明矾,明矾[KAl(SO4)2•12H2O]属于( )
| A. | 酸 | B. | 盐 | C. | 碱 | D. | 氧化物 |
9.短周期元素A、B、C、D、E的原子序数依次增大;A的一种核素在考古时常用来鉴定一些文物的年代,B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其K层电子数,而C的阳离子半径大于D的阳离子半径;若往E单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色的现象.下列说法中正确的是( )
| A. | B的氢化物和E的氢化物能反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 五种原子中E的原子半径最大 | |
| D. | A的最低价氢化物的沸点>B的最低价氢化物的沸点 |
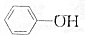 ,③
,③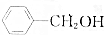 ,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )
,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )