题目内容
10.四种相邻的主族短周期元素的相对位置如表所示,元素x的原子核外电子数是m的2倍.下列说法中正确的是| m | n | ||
| x | y |
| A. | x最高价氧化对应水化物的碱性比y弱 | |
| B. | m可形成多种氢化物,而n只形成一种氢化物 | |
| C. | x的单质在m的最高价氧化物中燃烧,生成两种固体物质 | |
| D. | m、n两元素所形成的化合物分子中,既含有离子键,也含有共价键 |
分析 4种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,m和n位于第二周期、x和y位于第三周期;设x最外层含有z个电子,则m最外层含有z+2个电子,x原子核外电子数是m的2倍,则(z+2+2)×2=8+2+z,解得:z=2,则x是Mg元素、m是C元素、n元素N元素,据此结合元素周期律知识进行解答.
解答 解:4种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,m和n位于第二周期、x和y位于第三周期;设x最外层含有z个电子,则m最外层含有z+2个电子,x原子核外电子数是m的2倍,则(z+2+2)×2=8+2+z,解得:z=2,则x是Mg元素、y是Al元素、m是C元素、n元素N元素,
A.非金属性Mg大于Al,则最高价氧化物对应水合物碱性:Mg>Al,即:x最高价氧化对应水化物的碱性比y强,故A错误;
B.m为C,烃类都是C的氢化物,而n为N元素,N元素的氢化物不知一种,如氨气、N2H4(联氨),故B错误;
C.x的单质为金属Mg,m的最高价氧化物为二氧化碳,镁在二氧化碳中燃烧生成两种固体物质:氧化镁和C,故C正确;
D.m是C元素、n元素N元素,二者形成的化合物为(CN)2,其电子式为 ,不存在离子键,故D错误;
,不存在离子键,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,推断元素名称为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.碳及其化合物在自然界中和人类活动中发挥着重要的作用.回答下列问题:
(1)已知常温下,几种弱酸的电离常数如表:
①等物质的量浓度的CH3COONa、NaCN、Na2CO3三种溶液的pH分别为pH1、pH2、pH3,则三者由大到小的顺序为pH3>pH2>pH1
②0.4mol•L-1的CH3COOH溶液与0.2mol•L-1的NaOH溶液等体积混合后,所得溶液中c(H+)>c(OH-)(填“>”“<”或“=”,下同)c(CH3COOH)<c(CH3COO-)
(2)工业生产中用可溶性的碳酸盐浸取石膏固体,写出浸取过程中发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-;已知常温时${K}_{sp}(CaC{O}_{3})=2.80×1{0}^{-9}$,${K}_{sp}(CaS{O}_{4})=4.9×1{0}^{-5}$,则此温度下该离子反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$
(3)雾霾袭城的日子越来越多,其中对雾霾“贡献”较大的物质之一是氮氧化物,CH4催化还原可消除氮氧化物的污染. 已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
现采集NO2与NO的体积比为1:3的样品,用标准状况下22.4L的CH4处理该样品,恰好完全反应(已知生成物全部为气态)并放出1042.8kJ的热量,则△H2=-1160kJ/mol.
(1)已知常温下,几种弱酸的电离常数如表:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②0.4mol•L-1的CH3COOH溶液与0.2mol•L-1的NaOH溶液等体积混合后,所得溶液中c(H+)>c(OH-)(填“>”“<”或“=”,下同)c(CH3COOH)<c(CH3COO-)
(2)工业生产中用可溶性的碳酸盐浸取石膏固体,写出浸取过程中发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-;已知常温时${K}_{sp}(CaC{O}_{3})=2.80×1{0}^{-9}$,${K}_{sp}(CaS{O}_{4})=4.9×1{0}^{-5}$,则此温度下该离子反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$
(3)雾霾袭城的日子越来越多,其中对雾霾“贡献”较大的物质之一是氮氧化物,CH4催化还原可消除氮氧化物的污染. 已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
现采集NO2与NO的体积比为1:3的样品,用标准状况下22.4L的CH4处理该样品,恰好完全反应(已知生成物全部为气态)并放出1042.8kJ的热量,则△H2=-1160kJ/mol.
1.锌溴液流电池用溴化锌溶液作电解液,并在电池间不断循环.下列有关说法正确的是( )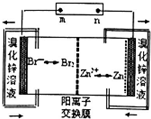

| A. | 充电时Zn2+通过阳离子交换膜由左侧流向右侧 | |
| B. | 放电时每转移2mol电子负极增重130g | |
| C. | 充电时阴极的电极反应式为Br2+2e-=2Br- | |
| D. | 若将电解液改为氯化锌溶液放电效果更好更安全 |
2.相同状况下的12C18O和14N2两种气体,下列说法正确的是( )
| A. | 若分子数相等,则体积相等 | B. | 若原子数相等,则中子数相等 | ||
| C. | 若质量相等,则质子数相等 | D. | 若体积相等,则质量数相等 |
20.X、Y、Z、W是四种短周期主族元素.原子序数依次增大,X是原子半径最小的,元素,元素Y的原子最外层电了数是其电子层数的2倍,元素Z的-1价阴离子和元素W的+3价阳离子的核外电子排布均与氖原子相同,下列说法中错误的是( )
| A. | X与Y形成的化合物可能含有非极性键 | |
| B. | X的单质与Z的单质在暗处能剧烈反应 | |
| C. | 含W的盐溶于水形成的溶液一定显酸性 | |
| D. | 离子半径:r(Z-)>r(W3+) |









 .
. .
. .
. .
.
 ;
;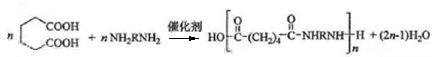 ;
; ;
; .
.