题目内容
(1)现有0.1mol?L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是
;
纯碱溶液呈碱性的原因是(用离子方程式表示) .
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案: .
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是 .
A.甲学生:在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应
B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应
C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应.
纯碱溶液呈碱性的原因是(用离子方程式表示)
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是
A.甲学生:在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应
B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应
C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应.
考点:测定溶液pH的方法,影响盐类水解程度的主要因素
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)根据PH试纸的使用方法分析;根据盐的类型分析;根据水解程度分析;
(2)设计实验使溶液中的CO32-由有到无,再根据酚酞的颜色变化起作用的是否是碳酸根离子.
(3)A.醋酸钠溶液中滴入酚酞试液,加热后若红色加深,则升高温度促进水解.
B.中和反应为放热反应,测定温度应注意隔热;
C.硝酸铵晶体溶于水吸收热量;
D.氨水溶液中加入氯化铵晶体,铵根离子浓度增大,引起化学平衡的移动.
(2)设计实验使溶液中的CO32-由有到无,再根据酚酞的颜色变化起作用的是否是碳酸根离子.
(3)A.醋酸钠溶液中滴入酚酞试液,加热后若红色加深,则升高温度促进水解.
B.中和反应为放热反应,测定温度应注意隔热;
C.硝酸铵晶体溶于水吸收热量;
D.氨水溶液中加入氯化铵晶体,铵根离子浓度增大,引起化学平衡的移动.
解答:
解:(1)PH试纸的正确使用方法是:把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH;纯碱是强碱弱酸盐,碳酸根离子能发生水解使溶液中的氢氧根离子的浓度大于氢离子的浓度,导致溶液呈碱性,离子方程式为 CO32-+H2O?HCO3-+OH-;
故答案为:把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH; CO32-+H2O?HCO3-+OH-;
(2)为证明纯碱溶液呈碱性是由CO32-引起的,就设计一个使溶液中的碳酸根离子由有到无的实验,根据溶液中酚酞颜色的变化判断.
故答案为:向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去.说明纯碱溶液呈碱性是由CO32-引起的.(3)A.醋酸钠溶液中滴入酚酞试液,加热后若红色加深,则升高温度促进水解,即水解反应为吸热反应,故A正确;
B.在盐酸中加入氨水,中和反应为放热反应,混合液温度上升,不能说明盐类水解是吸热的,故B错误;
C.因硝酸铵晶体溶于水吸收热量,则不能说明盐水解为吸热反应,故C错误;
D.氨水溶液中加入氯化铵晶体,铵根离子浓度增大,抑制氨水的电离,过程伴随热效应,则不能说明盐类水解是吸热的,故D错误;
故选A.
故答案为:把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH; CO32-+H2O?HCO3-+OH-;
(2)为证明纯碱溶液呈碱性是由CO32-引起的,就设计一个使溶液中的碳酸根离子由有到无的实验,根据溶液中酚酞颜色的变化判断.
故答案为:向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去.说明纯碱溶液呈碱性是由CO32-引起的.(3)A.醋酸钠溶液中滴入酚酞试液,加热后若红色加深,则升高温度促进水解,即水解反应为吸热反应,故A正确;
B.在盐酸中加入氨水,中和反应为放热反应,混合液温度上升,不能说明盐类水解是吸热的,故B错误;
C.因硝酸铵晶体溶于水吸收热量,则不能说明盐水解为吸热反应,故C错误;
D.氨水溶液中加入氯化铵晶体,铵根离子浓度增大,抑制氨水的电离,过程伴随热效应,则不能说明盐类水解是吸热的,故D错误;
故选A.
点评:本题考查化学实验方案的评价和pH的测定,注意判断盐类水解为吸热反应时应注意温度对水解反应的影响,明确晶体溶解伴随热效应是解答的易错点,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列食物富含蛋白质的是( )
| A、米饭 | B、鸡蛋 | C、黄瓜 | D、花生 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 2min后平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应可表示为X+3Y?2Z,其平衡常数为1600 |
| C、改变温度可以改变此反应的平衡常数 |
| D、用Y来表示的该反应的反应速率为0.025 mol?L-1min-1 |
称取两份铝粉,第一份加入足量的NaOH溶液中,第二份加入足量的盐酸中,若放出H2的体积相同(同温同压),则两份铝粉的质量比为( )
| A、1:2 | B、1:3 |
| C、3:2 | D、1:1 |
下列措施中不利于控制CO2排放的是( )
| A、在安全可靠的前提下,提高核电在电力生产中的份额 |
| B、积极开发利用氢能源、太阳能、地热能和潮汐能等新能源 |
| C、鼓励家庭购买轿车,适当限制公共交通的发展 |
| D、积极开展绿化国土的行动,建立绿色家园 |
已知:2NO2(g)
2NO(g)+O2(g)△H<0,下列关于该反应的示意图或描述不正确的是( )
| 催化剂 |
| 加热 |
A、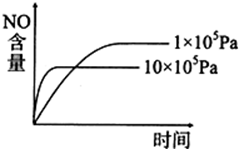 |
B、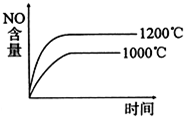 |
| C、NO难溶于水,可以用排水法收集,但不可以用排空气法 |
| D、当生成标准状况下3.36L的氧气时,该反应转移0.6mole |
已知NaHSO4在水中的电离方程式为:NaHSO4═Na++H++SO42-.某温度下,向c(H+)=1×10-6mol/L的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中的c(H+)=1×10-2 mol/L.下列对该溶液的叙述错误的是( )
| A、该温度高于25℃ |
| B、由水电离出来的H+的浓度为1×10-10 mol/L |
| C、NaHSO4晶体的加入抑制了水的电离 |
| D、取该溶液加水稀释100倍,溶液中的c(OH-)减小 |
 锌铜原电池装置如图所示,常常采用电池图式表达式,如:
锌铜原电池装置如图所示,常常采用电池图式表达式,如: