题目内容
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.

(1)在以上字母表示的短周期主族元素中,原子半径最大的是 (填元素符号).
(2)i元素在周期表中的位置是 .运用元素周期律判断,i元素的正二价硫酸盐是 (难溶或易溶)于水的固体.
(3)请用电子式表示a与g组成的化合物的形成过程 .
(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式 ;X与d的单质在加热条件下生成的化合物中存在的化学键类型是 .
(5)工业上制取Y和g的无水化合物方法如下:Y的氧化物与b、g的单质在高温条件下反应,每消耗6kg b的单质,过程中转移1×103mol电子,写出相应反应的化学方程式 .

(1)在以上字母表示的短周期主族元素中,原子半径最大的是
(2)i元素在周期表中的位置是
(3)请用电子式表示a与g组成的化合物的形成过程
(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式
(5)工业上制取Y和g的无水化合物方法如下:Y的氧化物与b、g的单质在高温条件下反应,每消耗6kg b的单质,过程中转移1×103mol电子,写出相应反应的化学方程式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表后者的位置可知,a为H、b为C、d为O、e为Mg、f为Si、g为Cl、h为Ar、i为Sr,
(1)同周期随原子序数增大原子半径增大,电子层越多原子半径越大;
(2)i为Sr处于第五周期ⅡA族;根据同主族硫酸盐--硫酸镁、硫酸钙、硫酸钡的溶解性分析;
(3)HCl属于共价化合物,用电子式表示其形成过程,左侧为原子电子式,右侧为HCl电子式,中间用→连接;
(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,则X、Y处于第三周期,Y离子半径在同周期元素简单离子半径中最小,则Y为Al,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,则X为Na,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,钠与氧气在加热条件下生成过氧化钠,属于离子化合物,过氧根离子中氧原子之间形成非极性键;
(5)Y和g的无水化合物为AlCl3,工业上用氧化铝、碳、氯气在高温条件下反应制得,整个中注意C、Cl的化合价发生变化,消耗6kg碳的单质,过程中转移1×103mol电子,令C元素在氧化产物中化合价为a,则
×a=1×103mol,解得a=2,故生成CO,据此配平书写方程式.
(1)同周期随原子序数增大原子半径增大,电子层越多原子半径越大;
(2)i为Sr处于第五周期ⅡA族;根据同主族硫酸盐--硫酸镁、硫酸钙、硫酸钡的溶解性分析;
(3)HCl属于共价化合物,用电子式表示其形成过程,左侧为原子电子式,右侧为HCl电子式,中间用→连接;
(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,则X、Y处于第三周期,Y离子半径在同周期元素简单离子半径中最小,则Y为Al,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,则X为Na,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,钠与氧气在加热条件下生成过氧化钠,属于离子化合物,过氧根离子中氧原子之间形成非极性键;
(5)Y和g的无水化合物为AlCl3,工业上用氧化铝、碳、氯气在高温条件下反应制得,整个中注意C、Cl的化合价发生变化,消耗6kg碳的单质,过程中转移1×103mol电子,令C元素在氧化产物中化合价为a,则
| 6000g |
| 12g/mol |
解答:
解:由元素在周期表后者的位置可知,a为H、b为C、d为O、e为Mg、f为Si、g为Cl、h为Ar、i为Sr,
(1)同周期随原子序数增大原子半径增大,电子层越多原子半径越大,故Sr的原子半径最大,
故答案为:Sr;(2)i为Sr处于第五周期ⅡA族;同主族中硫酸镁、硫酸钙、硫酸钡的溶解性依次减小,二者同主族中Sr介于Ca与Ba之间,溶解性应小于硫酸钙,故Sr元素的正二价硫酸盐应难溶于水,
故答案为:第五周期ⅡA族;难溶;
(3)HCl属于共价化合物,用电子式表示其形成过程为: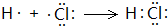 ,故答案为:
,故答案为: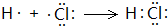 ;
;
(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,则X、Y处于第三周期,Y离子半径在同周期元素简单离子半径中最小,则Y为Al,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,则X为Na,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:SiO2+2OH-=SO32-+H2O,钠与氧气在加热条件下生成过氧化钠,属于离子化合物,过氧根离子中氧原子之间形成非极性键,过氧化钠中含有离子键、非极性键,
故答案为:SiO2+2OH-=SO32-+H2O;离子键、非极性键;
(5)Y和g的无水化合物为AlCl3,工业上用氧化铝、碳、氯气在高温条件下反应制得,整个中注意C、Cl的化合价发生变化,消耗6kg碳的单质,过程中转移1×103mol电子,令C元素在氧化产物中化合价为a,则
×a=1×103mol,解得a=2,故生成CO,故反应方程式为:Al2O3+3C+3Cl2
2AlCl3+3CO,
故答案为:Al2O3+3C+3Cl2
2AlCl3+3CO.
(1)同周期随原子序数增大原子半径增大,电子层越多原子半径越大,故Sr的原子半径最大,
故答案为:Sr;(2)i为Sr处于第五周期ⅡA族;同主族中硫酸镁、硫酸钙、硫酸钡的溶解性依次减小,二者同主族中Sr介于Ca与Ba之间,溶解性应小于硫酸钙,故Sr元素的正二价硫酸盐应难溶于水,
故答案为:第五周期ⅡA族;难溶;
(3)HCl属于共价化合物,用电子式表示其形成过程为:
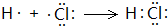 ,故答案为:
,故答案为: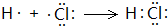 ;
;(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,则X、Y处于第三周期,Y离子半径在同周期元素简单离子半径中最小,则Y为Al,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,则X为Na,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:SiO2+2OH-=SO32-+H2O,钠与氧气在加热条件下生成过氧化钠,属于离子化合物,过氧根离子中氧原子之间形成非极性键,过氧化钠中含有离子键、非极性键,
故答案为:SiO2+2OH-=SO32-+H2O;离子键、非极性键;
(5)Y和g的无水化合物为AlCl3,工业上用氧化铝、碳、氯气在高温条件下反应制得,整个中注意C、Cl的化合价发生变化,消耗6kg碳的单质,过程中转移1×103mol电子,令C元素在氧化产物中化合价为a,则
| 6000g |
| 12g/mol |
| ||
故答案为:Al2O3+3C+3Cl2
| ||
点评:本题考查元素周期表与元素周期律综合应用,难度中等,注意掌握电子式表示物质或化学键的形成,(5)中注意计算化合价确定生成为CO.

练习册系列答案
相关题目
一定条件下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0mol COCl2(g),经过一段时间后达到平衡.反应过程中测得的有关数据见下表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
10g下列金属与100mL 1mol/L的盐酸反应,产生气体物质的量最多的是( )
| A、Na | B、Mg | C、Fe | D、Al |

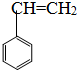 ;②CH3-CH=CH-CH3; ③CH2=CH-CH=CH2;④CH≡C-CH3;⑤
;②CH3-CH=CH-CH3; ③CH2=CH-CH=CH2;④CH≡C-CH3;⑤
 在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量.请回答下列问题: