题目内容
14.有关晶体与导电性的关系叙述正确的是( )| A. | 水溶液导电的一定是分子晶体 | B. | 熔融态导电的一定是离子晶体 | ||
| C. | 原子晶体固态一定不导电 | D. | 分子晶体熔融态一定不导电 |
分析 A、共价化合物和离子化合物的水溶液都可能导电;
B、熔融态能够导电的物质有金属晶体和离子晶体;
C、原子晶体硅固态时导电;
D、分子晶体熔化是分子间作用力的变化.
解答 解:A、共价化合物和离子化合物的水溶液都可能导电,所以不一定是分子晶体,故A错误;
B、熔融态能够导电的物质有金属晶体和离子晶体,所以熔融态导电的一定是离子晶体,故B错误;
C、原子晶体硅固态时导电,故C错误;
D、分子晶体熔化是分子间作用力的变化,而微粒的种类不变,所以分子晶体熔融态一定不导电,故D正确;
故选D.
点评 本题考查了物质的导电性与物质类型的关系,导电的物质中含有自由移动的离子或电子,注意:导电的物质不一定是电解质,电解质不一定导电,为易错点.

练习册系列答案
相关题目
2.下列事实不能用元素周期律解释的是( )
| A. | 向Na2SO3溶液中加盐酸,有气泡产生 | |
| B. | 0.1 mol•L-1溶液的pH:NaOH>LiOH | |
| C. | Mg、Al与同浓度盐酸反应,Mg更剧烈 | |
| D. | 气态氢化物的稳定性:HBr>HI |
9.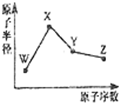 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A. | 对应简单离子半径:W>X | |
| B. | 对应气态氢化物的稳定性:Y<Z | |
| C. | 化合物XZW既含离子键,又含极性共价键 | |
| D. | Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应 |
19.向含MgCl2、AlCl3均为nmol的混合液中逐滴加入NaOH溶液至过量,生成沉淀与加入NaOH的物质的量关系正确的是( )(有关离子沉淀或沉淀溶解与pH关系如表)
| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. | 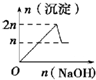 | B. |  | C. |  | D. | 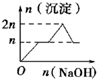 |
3.理论上下列反应不能设计成原电池反应的是( )
| A. | 2Fe3++Cu═2Fe2++Cu2+ | B. | Zn+2H+═Zn2++H2↑ | ||
| C. | 2H2+O2═2H2O | D. | H++OH-═H2O |
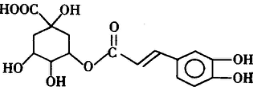
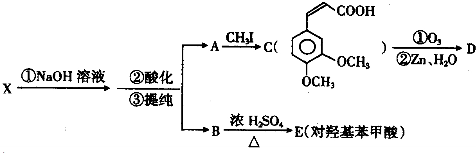
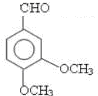 ;
;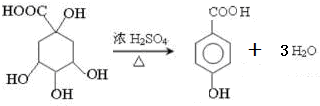 ;
;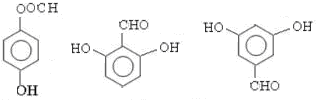 任意一种(任写一种)
任意一种(任写一种)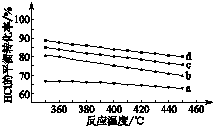 用Cl2生产含氯有机物时会产生HCl.利用反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)可实现氯的循环利用.
用Cl2生产含氯有机物时会产生HCl.利用反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)可实现氯的循环利用.