题目内容
2.某实验探究小组为了验证红热的炭与浓硫酸发生反应所生成的各种产物,设计了一个实验流程,其装置图如图.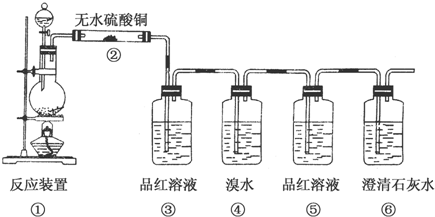
(1)①中反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)②处的现象是白色固体变蓝色.
(3)品红溶液使用了两次,③的作用是检验是否有SO2生成,⑤的作用是检验SO2是否除净.
(4)④的作用是除去SO2;反应的化学方程式为SO2+Br2+2H2O═H2SO4+2HBr.
(5)根据⑤中品红溶液无明显现象,⑥中澄清石灰水变浑浊现象可证明产物中一定有CO2气体.
(6)同学甲认为撤去装置⑤也可以确定CO2的存在,他所根据的实验现象是④中的溴水溶液不褪色(或变浅),⑥中澄清石灰水变浑浊.
(7)同学乙认为④中的溶液挥发出有毒的Br2蒸气,建议换成另外一种中学常见的有色溶液更安全,这种溶液是酸性高锰酸钾溶液.
分析 (1)木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水;
(2)验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水;
(3)验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水,再验证二氧化硫,能使品红试液褪色,除去二氧化硫后再用品红试液检验是否除尽,最后用澄清石灰验证二氧化碳;
(4)④装有溴水,主要是氧化二氧化硫而除去二氧化硫,溴单质在水溶液中氧化二氧化硫生成硫酸和溴化氢;
(5)根据在没有二氧化硫的情况下能使澄清石灰水变浑浊,则可证明产物中一定有CO2气体;
(6)撤去装置⑤也可以确定CO2的存在,可以依据装置④中溴水不褪色证明二氧化硫吸收完全,装置⑥中变浑浊证明生成二氧化碳;
(7)④中的溶液挥发出有毒的Br2蒸气,可以选择高锰酸钾溶液氧化二氧化硫吸收,且无污染物生成.
解答 解:(1)木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)验证碳和浓硫酸反应的产物需要先验证生成的水,则②处的现象是无水硫酸铜变蓝色说明生成水,故答案为:白色固体变蓝色;
(3)验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水,再验证二氧化硫,能使品红试液褪色,除去二氧化硫后再用品红试液检验是否除尽,最后用澄清石灰验证二氧化碳;所以第一次使用二氧化硫时的作用是检验是否有SO2生成,第二次使用二氧化硫的作用是检验SO2是否除净,
故答案为:检验是否有SO2生成;检验SO2是否除净;
(4)④装有溴水,主要是氧化二氧化硫而除去二氧化硫,所以该反应表现了二氧化硫的还原性,反应的离子方程式为:SO2+Br2+2H2O═H2SO4+2HBr;
故答案为:除去SO2;SO2+Br2+2H2O═H2SO4+2HBr;
(5)根据第二次品红溶液不褪色,澄清石灰水变浑浊,说明二氧化硫没有了,则能使澄清石灰水变浑浊,则可证明产物中一定有CO2气体,
故答案为:⑤中品红溶液无明显现象,⑥中澄清石灰水变浑浊;
(6)撤去装置⑤也可以确定CO2的存在,可以依据装置④中溴水不褪色证明二氧化硫吸收完全,装置⑥中变浑浊证明生成二氧化碳,同学甲认为撤去装置⑤也可以确定CO2的存在,他所根据的实验现象是④中的溴水溶液不褪色(或变浅),⑥中澄清石灰水变浑浊;
故答案为:④中的溴水溶液不褪色(或变浅),⑥中澄清石灰水变浑浊;
(7)④中的溶液挥发出有毒的Br2蒸气,可以换做酸性高锰酸钾溶液,主要是氧化二氧化硫而除去二氧化硫,所以该反应表现了二氧化硫的还原性;
故答案为:酸性高锰酸钾溶液.
点评 本题考查了浓硫酸性质的应用,产物验证方法和现象判断,注意二氧化碳、二氧化硫都可以使澄清石灰水变浑浊,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案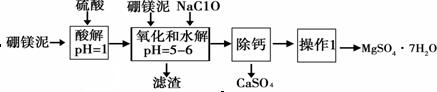
根据题意回答下列问题:
(1)实验中需用1mol•L-1的硫酸80mL,若用98%的浓硫酸配制,除量筒、玻璃棒外,还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管.
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果提供的硼镁泥共100g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为80%.
| A. | HX | B. | H2X | C. | XH3 | D. | XH5 |
| A. | 钠和镁分别与冷水反应,判断钠和镁的金属性强弱 | |
| B. | 铁投入CuSO4溶液中置换出铜,判断铜与铁的金属性强弱 | |
| C. | 酸性H2CO3<HCl,判断氯与碳的非金属性强 | |
| D. | F2与Cl2分别与足量的H2反应的难易,判断氟与氯的非金属性强弱 |
| A. | 由极性键构成的极性分子 | B. | 由极性键构成的非极性分子 | ||
| C. | 由非极性键构成的极性分子 | D. | CO2中C采取sp2杂化 |
试回答下列问题:
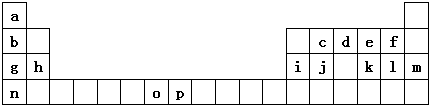
(1)元素p的原子的电子占有7种能量不同的原子轨道.
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为O2->F->Na+>Mg2+(用离子符号表示)
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为sp3,该分子是极性(填“极性”或“非极性”)分子.
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量.
(5)o、p两元素的部分电离能数据列于下表:
| 元素 | O | p | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为NH4NO3,含有的化学键为离子键、共价键、配位键.
| A. | K+、CO32-、HS-、S2-、Al3+、AlO2- | B. | MnO4-、Na+、SO42-、K+、Cl- | ||
| C. | SO42-、Ag+、SO32-、S2-、AlO2-、K+ | D. | Fe3+、Cl-、H+、NO3- |
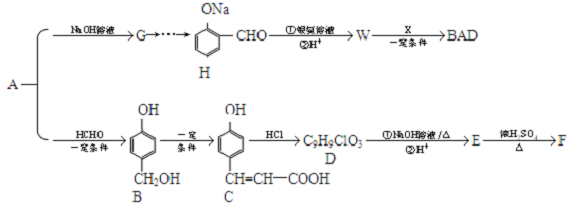
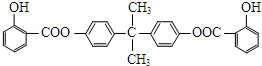
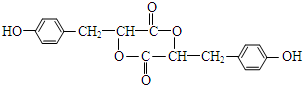
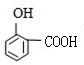 .
.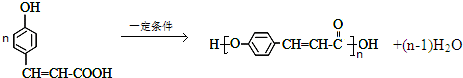 .
. .
.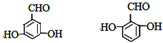 (其中一种).
(其中一种).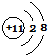 .D在周期表中位置第三周期第ⅥA族.
.D在周期表中位置第三周期第ⅥA族.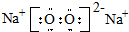 .
.