题目内容
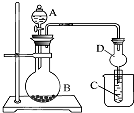
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.

(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气.将装CaCO3的干燥管下移与稀HNO3反应产生CO2,当看到C处出现 现象可以确定E中空气已被赶尽:
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为: .
(3)如何证明E中收集到的是NO而不是H2? 当证明出是NO后,C中白色沉淀溶解,其原因是
(4)装置D的作用是 .

(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气.将装CaCO3的干燥管下移与稀HNO3反应产生CO2,当看到C处出现
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为:
(3)如何证明E中收集到的是NO而不是H2?
(4)装置D的作用是
考点:性质实验方案的设计
专题:
分析:实验时,可先将B装置中CaCO3放入硝酸中,碳酸钙和硝酸反应生成二氧化碳气体,先排出去其中的空气,以便在E烧瓶中收集到NO,以便观察颜色,且在C中可观察到浑浊,有碳酸钙沉淀生成,A中硝酸和铜反应生成NO,易于氧气反应,则将F气球中空气压入E中,有红棕色气体生成,装置D中盛有氢氧化钠溶液,可用与吸收二氧化氮气体,气体中气球可用于吸收不反应的NO,以防止污染空气,以此解答该题.
解答:
解:(1)实验时,可先将B装置中CaCO3放入硝酸中,碳酸钙和硝酸反应生成二氧化碳气体,先排出去其中的空气,以便在E烧瓶中收集到NO,以便观察颜色;E中空气已被赶尽时,E中石灰水与二氧化碳反应生成碳酸钙沉淀,可观察到石灰水变浑浊,
故答案为:石灰水变浑浊;
(2)稀硝酸与铜反应生成硝酸铜和NO,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)A中硝酸和铜反应生成NO,易于氧气反应生成二氧化氮,一氧化氮为无色气体,二氧化氮为红棕色气体,若将F气球中空气压入E中,有红棕色气体生成,则说明生成二氧化氮,证明E中收集到的是NO而不是氢气,
生成二氧化碳通入C中生成硝酸,硝酸与碳酸钙反应,反应的化学方程式为2HNO3+CaCO3═Ca(NO3)2+2H2O,所以C中白色沉淀溶解;
故答案为:将F气球中空气压入E中,有红棕色气体生成;NO2和水反应生成硝酸,硝酸使沉淀溶解;
(4)装置D中盛有氢氧化钠溶液,可用与吸收二氧化氮气体,气体中气球可用于吸收不反应的NO,以防止污染空气,
故答案为:吸收多余的NO、NO2.
故答案为:石灰水变浑浊;
(2)稀硝酸与铜反应生成硝酸铜和NO,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)A中硝酸和铜反应生成NO,易于氧气反应生成二氧化氮,一氧化氮为无色气体,二氧化氮为红棕色气体,若将F气球中空气压入E中,有红棕色气体生成,则说明生成二氧化氮,证明E中收集到的是NO而不是氢气,
生成二氧化碳通入C中生成硝酸,硝酸与碳酸钙反应,反应的化学方程式为2HNO3+CaCO3═Ca(NO3)2+2H2O,所以C中白色沉淀溶解;
故答案为:将F气球中空气压入E中,有红棕色气体生成;NO2和水反应生成硝酸,硝酸使沉淀溶解;
(4)装置D中盛有氢氧化钠溶液,可用与吸收二氧化氮气体,气体中气球可用于吸收不反应的NO,以防止污染空气,
故答案为:吸收多余的NO、NO2.
点评:本题以硝酸的性质为载体综合考查性质实验的设计,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,明确实验目的和原理是解答该题的关键,注意相关实验操作方法的注意事项,难度中等.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案
相关题目
下列说法中,正确的是( )
| A、难溶电解质都是弱电解质 |
| B、难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 |
| C、在白色ZnS沉淀上滴加CuSO4溶液,沉淀变黑色,说明CuS比ZnS更难溶于水 |
| D、相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同 |
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )

| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛氯化钙溶液,则C中溶液变浑浊 |
| C、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、实验仪器D可以起到防止溶液倒吸的作用 |
对于苯乙烯的下列叙述其中完全正确的是( )
①能使酸性KMnO4溶液褪色;
②可发生加聚反应;
③可溶于水;
④可溶于苯中;
⑤苯环能与溴水发生取代反应;
⑥所有的原子可能共面,且最多有5个原子共线.
①能使酸性KMnO4溶液褪色;
②可发生加聚反应;
③可溶于水;
④可溶于苯中;
⑤苯环能与溴水发生取代反应;
⑥所有的原子可能共面,且最多有5个原子共线.
| A、①②④ | B、①②④⑥ |
| C、①②④⑤⑥ | D、①②③④⑤⑥ |
将0.2mol?L-1MOH溶液和0.1mol?L-1HCl的溶液等体积混合后,溶液呈酸性,下列关系式中不正确的是( )
| A、c(MOH)>c(M+) |
| B、c(M+)+c(H+)=c(Cl-)+c(OH-) |
| C、c(MOH)+c(M+)=0.2mol?L-1 |
| D、c(M+)<c(Cl-) |

 A,B,C,D,E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,且焰色反应呈浅紫色(透过蓝色钴玻璃).B为难溶的白色固体,A和E的阴离子相同.请回答下了问题:
A,B,C,D,E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,且焰色反应呈浅紫色(透过蓝色钴玻璃).B为难溶的白色固体,A和E的阴离子相同.请回答下了问题: