题目内容
1.下列说法不正确的是( )| A. | 实验室少量的金属钠保存在煤油或石蜡油里 | |
| B. | 金属钠着火,用干燥的沙土来灭火 | |
| C. | 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | |
| D. | 铁制炊具不宜用来煎炒食物,因为铁要与水反应 |
分析 A.钠是活泼的金属,易和水、氧气反应,钠的密度大于煤油的密度,所以要保存钠应该隔绝空气和水蒸气保存;
B.钠与氧气反应 生成过氧化钠,过氧化钠可与二氧化碳反应生成碳酸钠和氧气,则钠失火时不能用泡沫灭火器灭火;
C.氧化铝属于两性氧化物,Al、Al2O3和强碱反应生成可溶性偏铝酸盐,和酸反应生成氯化铝;
D.铁与热水不反应.
解答 解:A.钠的密度小于煤油的密度,且和煤油不反应,所以钠可以保存在煤油中而隔绝空气和水,故A正确;
B.钠与氧气反应 生成过氧化钠,过氧化钠可与二氧化碳反应生成碳酸钠和氧气,则钠失火时不能用泡沫灭火器灭火,可以用干燥的沙土灭火,故B正确;
C.Al、Al2O3都能与酸和碱反应,所以铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物,故C正确;
D.铁与热水不反应,铁制炊具可以用来煎炒食物,故D错误;
故选:D.
点评 本题考查了生活中的化学,熟悉生活中常见金属的性质是解题关键,题目难度不大,注意相关知识的积累.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
12.对于反应2HI(g)?H2(g)+I2(g),下列叙述能够说明已达平衡状态的是( )
| A. | 混合气体的颜色不再变化 | |
| B. | 温度和体积一定时,容器内压强不再变化 | |
| C. | 1molH-H键生成的同时有2molH-I键断裂 | |
| D. | 各物质的物质的量浓度之比为2:1:1 |
9.乙烯和丙烯按1:1(物质的量)聚合时,生成聚合乙丙树脂,该聚合物的结构是( )


| A. | ①② | B. | ②③ | C. | ①④ | D. | ①③ |
16.有一透明溶液甲,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Ba2+、SO42-、Cl-、I-、HCO3-,现取该溶液实验如表:
(1)由实验步骤①判断出溶液中肯定不存在的离子是HCO3-,能说明这一实验事实的离子方程式是H++HCO3-=CO2↑+H2O
(2)实验步骤③的实验结果说明溶液中不存在I-离子
(3)欲确定的离子中肯定存在的是Mg2+、Al3+、Cl-.
(4)为进一步确定其他离子,应该补充的实验是C
A.蒸发 B.过滤C.焰色反应 D.渗析.
| 实验步骤 | 实验现象 |
| ①取少量甲溶液,滴加几滴甲基橙 | 溶液变红色 |
| ②取少量甲溶液,滴加Ba(NO3)2溶液 | 溶液无明显变化 |
| ③取②中实验后的溶液,滴加AgNO3溶液 | 有白色沉淀生成,且不溶于HNO3 |
| ④取少量甲溶液,滴加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(2)实验步骤③的实验结果说明溶液中不存在I-离子
(3)欲确定的离子中肯定存在的是Mg2+、Al3+、Cl-.
(4)为进一步确定其他离子,应该补充的实验是C
A.蒸发 B.过滤C.焰色反应 D.渗析.
6.下列叙述中正确的是( )
| A. | 氧化钠溶于水与水反应后电离生成钠离子和氢氧根离子,因而氧化钠是非电解质 | |
| B. | NH3、SO3的水溶液均导电,所以NH3、SO3均是电解质 | |
| C. | 能电离出H+的化合物都是酸,能电离出OH-的化合物都是碱 | |
| D. | 液态HCl、固体NaCl均是电解质,但液态HCl和固体NaCl均不导电 |
13.下列原子轨道中,轨道数为5的是( )
| A. | 5s | B. | 3d | C. | 5p | D. | 5f |
10.下列说法不正确的是( )
| A. | 向海带灰浸取液中滴加硫酸、过氧化氢和淀粉后,溶液变蓝,说明海带中含碘 | |
| B. | 向浓缩海水中通入氯气,再吹入空气,可以将溴从海水中提取出来 | |
| C. | 埋入地下的铁制管道用连接镁的方法加以防护 | |
| D. | 石油的分馏和煤的干馏都属于化学变化 |
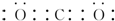
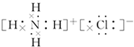

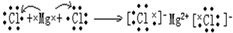 .
.