题目内容
20.为除去下列物质中少量的杂质(括号内),请写出所加的试剂或操作,并写出相应的化学方程式.若是离子反应请写离子方程式.(1)Na2CO3固体(NaHCO3):加热,2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)MgO(Al2O3):NaOH溶液,Al2O3+2OH-=2AlO2-+H2O.
(3)CO2(HCl):NaHCO3溶液,HCO3-+H+=CO2↑+H2O.
分析 (1)NaHCO3不稳定,加热易分解,可用加热的方法除杂;
(2)氧化铝是两性氧化物,可以与强酸、强碱反应,利用氧化铝与强碱反应而氧化镁不能反应除去MgO中混有少量Al2O3;
(3)盐酸的酸性比碳酸强,故HCl能和碳酸氢钠反应,而二氧化碳和碳酸氢钠不反应.
解答 解:(1)NaHCO3不稳定,加热易分解,可用加热的方法除杂,化学方程式为:2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O,无离子方程式,故答案为:加热;2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)MgO是碱性氧化物,只能和酸反应,Al2O3是两性氧化物,既能和酸反应又能和碱反应,故可以用碱来除去MgO中的氧化铝,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:NaOH溶液;Al2O3+2OH-=2AlO2-+H2O;
(3)盐酸的酸性比碳酸强,故HCl能和碳酸氢钠反应,而二氧化碳和碳酸氢钠不反应,HCl能和NaHCO3溶液反应的离子方程式为:HCO3-+H+=CO2↑+H2O,故答案为:NaHCO3溶液;HCO3-+H+=CO2↑+H2O;
点评 本题考查物质的分离、提纯,为高考常见题型,除杂时要注意不能引入新的杂质,更不能影响被提纯的物质,难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
11.下列属于碱性氧化物的是( )
| A. | Na2O2 | B. | Fe3O4 | C. | CaO | D. | MnO(OH) |
8. 垃圾的分类收集是实现垃圾处理无害化、减量化和资源化的重要措施.向贴有如图所示标志的垃圾箱中丢弃的垃圾应是( )
垃圾的分类收集是实现垃圾处理无害化、减量化和资源化的重要措施.向贴有如图所示标志的垃圾箱中丢弃的垃圾应是( )
 垃圾的分类收集是实现垃圾处理无害化、减量化和资源化的重要措施.向贴有如图所示标志的垃圾箱中丢弃的垃圾应是( )
垃圾的分类收集是实现垃圾处理无害化、减量化和资源化的重要措施.向贴有如图所示标志的垃圾箱中丢弃的垃圾应是( )| A. | 厨房垃圾 | B. | 可回收垃圾 | C. | 有害垃圾 | D. | 其他垃圾 |
15.下列关于氯水的叙述正确的是( )
| A. | 新制氯水中只含Cl2和H2O分子 | |
| B. | 新制氯水加入滴有酚酞的NaOH溶液中,褪色说明氯水中含有Cl2 | |
| C. | 氯水放置数天后酸性将变弱 | |
| D. | 新制氯水可使蓝色石蕊试纸先变红后褪色 |
5.设阿伏加德罗常数的值为NA,下列说法正确的是( )
| A. | 3.1 g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1mol${\;}_{35}^{81}$Br原子中含中子数为3.5NA | |
| C. | 标准状况下,11.2LCHCl3中含有C-Cl键的数目为1.5NA | |
| D. | 0.5L1.0mol•L-1NH4Al(SO4)2溶液中含有的NH${\;}_{4}^{+}$数目为0.5NA |
7.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 2.3 g Na变成Na+时,失去的电子数为0.2NA | |
| B. | 0.2NA个H2SO4与19.6 g H3PO4含有相同的氧原子数 | |
| C. | 28 g N2与CO的混合气体,所含的原子数为NA | |
| D. | 含有NA个氧原子的H2SO4的物质的量是4 mol |
4.以下说法不正确的是( )
| A. | 常温常压下,1mol氮气所含的分子数为NA个 | |
| B. | 在10℃时,1mol氮气所占体积大于22.4L | |
| C. | 常温常压下,28g氮气所占的体积大于22.4L | |
| D. | 标况下,以任意比混合的CO、CO2气体22.4L,所含分子总数为NA 个 |
 某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿点燃酒精灯加热铜丝.
某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿点燃酒精灯加热铜丝.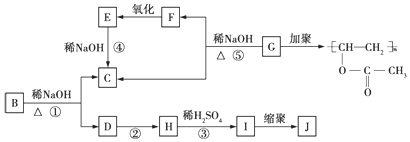
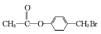
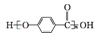 .
.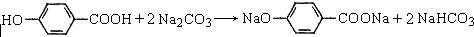 .
.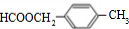 、
、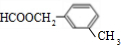 、
、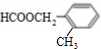 、
、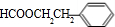 、
、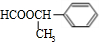 任一种.
任一种.