题目内容
4.以下说法不正确的是( )| A. | 常温常压下,1mol氮气所含的分子数为NA个 | |
| B. | 在10℃时,1mol氮气所占体积大于22.4L | |
| C. | 常温常压下,28g氮气所占的体积大于22.4L | |
| D. | 标况下,以任意比混合的CO、CO2气体22.4L,所含分子总数为NA 个 |
分析 A.结合N=nNA计算;
B.10℃时,压强未知,则Vm不确定;
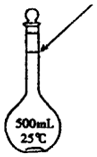
C.常温下的温度(25℃)大于标准状况下的温度(0℃),由PV=nRT,一定条件下物质的量相同的气体,温度高则体积大;
D.标准状况下Vm=22.4L/mol,结合n=$\frac{V}{Vm}$、N=nNA计算.
解答 解:A.常温常压下,1mol氮气所含的分子数为1mol×NA=NA个,故A正确;
B.10℃时,压强未知,则Vm不确定,则不能确定1mol氮气所占体积,故B错误;
C.氮气的物质的量为$\frac{28g}{28g/mol}$=1mol,常温下的温度(25℃)大于标准状况下的温度(0℃),由PV=nRT,一定条件下物质的量相同的气体,温度高则体积大,则氮气所占的体积大于22.4L,故C正确;
D.混合气体的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,分子总数为1mol×NA=NA个,故D正确;
故选B.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意Vm与温度、压强有关,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
19.下列属于化学变化的是( )
| A. | 干冰升华 | B. | 氯气液化 | C. | 海水晒盐 | D. | 钢铁生锈 |
12.由水电离出的c(OH-)=1×10-13 mol•L-1的无色溶液中,一定能大量共存的离子组是( )
| A. | Cl-、HCO3-、Na+、K+ | B. | Fe3+、NO3-、K+、H+ | ||
| C. | NO3-、Ba2+、K+、Cl- | D. | Al3+、SO42-、NH4+、Cl- |
19.下列指定反应的离子方程式正确的是( )
| A. | 将铜丝插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 漂白粉中加入浓盐酸:ClO-+Cl-+H2O═Cl2↑+2OH- | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ |
9.下列实验操作中,所用仪器合理的是( )
| A. | 在蒸发皿中放入NaCl溶液,加热、蒸发得到NaCl晶体 | |
| B. | 用10 mL量筒量取4.80 mL的盐酸 | |
| C. | 用托盘天平秤取25.20g NaCl | |
| D. | 用1000mL容量瓶配制450mL0.1 mol/L的盐酸 |
16.实验室里用一氧化碳还原由FeO、Fe2O3、Fe3O4组成的混合物,并将生成的气体通入足量的澄清石灰水中,最后测得生成的铁和碳酸钙的质量比为21:50,则这种混合物中FeO、Fe2O3、Fe3O4的物质的量之比不可能的是( )
| A. | 1:2:1 | B. | 3:3:1 | C. | 7:7:9 | D. | 1:1:1 |
14.下列反应中都有水的参加,其中水既不做氧化剂,又不做还原剂的氧化还原反应是( )
| A. | Cl2+H2O═HCl+HClO | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | C+H2O═CO+H2 |
 氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题: