题目内容
20.在水溶液中,下列电离方程式中,书写正确的是( )| A. | H2CO3?2H++CO32- | B. | NaHSO4?Na++HSO4- | ||
| C. | H2S+H2O?HS-+H3O+ | D. | Ca(OH)2?Ca2++2OH- |
分析 A.碳酸是弱电解质,分两步电离且部分电离,第一步电离生成氢离子和碳酸氢根离子;
B.硫酸氢钠在水溶液中完全电离生成氢离子、钠离子和硫酸根离子;
C.硫化氢是二元弱酸,分步电离且第一步电离生成水合氢离子和硫氢根离子;
D.氢氧化钙是强电解质,完全电离生成钙离子和氢氧根离子.
解答 解:A.碳酸是弱电解质,分两步电离且部分电离,第一步电离生成氢离子和碳酸氢根离子,电离方程式为CO3?H++HCO3-,故A错误;
B.硫酸氢钠在水溶液中完全电离生成氢离子、钠离子和硫酸根离子,电离方程式为NaHSO4=Na++H++SO4-,故B错误;
C.硫化氢是二元弱酸,分步电离且第一步电离生成水合氢离子和硫氢根离子,电离方程式为H2S+H2O?HS-+H3O+,故C正确;
D.氢氧化钙是强电解质,完全电离生成钙离子和氢氧根离子,电离方程式为Ca(OH)2=Ca2++2OH-,故D错误;
故选C.
点评 本题考查电离方程式的书写,侧重考查学生分析判断能力,明确电解质强弱及电离出的离子是解本题关键,注意硫酸氢钠在水溶液中和熔融状态下电离方式的不同点,题目难度不大.

练习册系列答案
相关题目
10.下列离子方程式,书写正确的是( )
| A. | 硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 盐酸与碳酸钠溶液反应CO32-+2H+═CO2↑+H2O | |
| C. | 硝酸银溶液中加入铜粉Ag++Cu═Cu2++Ag | |
| D. | 铁与稀盐酸反应2Fe+6H+═2Fe3++3H2↑ |
15.下列电离方程式错误的是( )
| A. | Ba( NO3-)2=Ba2++( NO3-) 2 | B. | NaHSO4=Na++H++SO42- | ||
| C. | H2SO4=2H++SO42- | D. | KClO3=K++ClO3- |
5.在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g)?3C(g)+D(g),平衡时C的浓度为amol•L-1.若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol•L-1的是( )
| A. | 4molA+2molB | B. | 3molC+1molB+1molD+1molA | ||
| C. | 2molA+1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
12.五种元素在周期表中的位置如图所示,其中X、Y、W、Z为短周期元素,所列五种元素的原子最外层电子数之和为26.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最简单氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
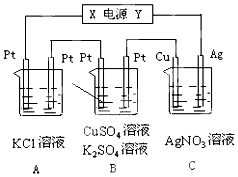 如图所示,溶液体积均为200mL,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,溶液体积均为200mL,若电解5min时铜电极质量增加2.16g,试回答: CO2与H2合成甲醚的主要反应如下:
CO2与H2合成甲醚的主要反应如下: