题目内容
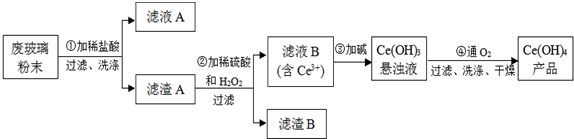
工业上用铝土矿(主要成分Al2O3,还含有Fe2O3、SiO2)提取氧化铝作冶炼铝的原料,提取的操作过程如图:
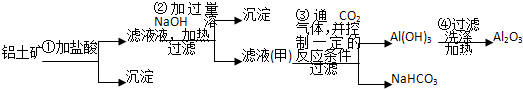
(1)写出步骤①②③④的化学方程式(是离子反应的用离子方程式表示)
①
②
③
④
(2)请写出铝热剂Fe2O3与Al发生反应的化学方程式,并说明该反应的一个用途.
;
.

(1)写出步骤①②③④的化学方程式(是离子反应的用离子方程式表示)
①
②
③
④
(2)请写出铝热剂Fe2O3与Al发生反应的化学方程式,并说明该反应的一个用途.
考点:物质分离和提纯的方法和基本操作综合应用,金属冶炼的一般原理
专题:实验设计题
分析:(1)铝土矿加过量盐酸溶解,Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,所以沉淀为不溶物SiO2;滤液A中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子和氢氧化钠反应生成氢氧化铁沉淀,生成的氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以沉淀C的成分是氢氧化铁;滤液甲中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,氢氧化铝沉淀加热可以得到氧化铝,即2Al(OH)3
Al2O3+3H2O,
(2)金属铝可以和氧化铁之间发生铝热反应,得到金属铁和氧化铝,反应是放热的,可以焊接铁轨.
| ||
(2)金属铝可以和氧化铁之间发生铝热反应,得到金属铁和氧化铝,反应是放热的,可以焊接铁轨.
解答:
解:(1)铝土矿加过量盐酸溶解,Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,所以沉淀为不溶物SiO2;滤液A中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子和氢氧化钠反应生成氢氧化铁沉淀,生成的氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以沉淀C的成分是氢氧化铁;滤液甲中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,氢氧化铝沉淀加热可以得到氧化铝,即2Al(OH)3
Al2O3+3H2O,即步骤①②③④的化学方程式分别是:
①Fe2O3+6H+=2Fe3++3H2O,Al2O3+6H+=2Al3++3H2O;
②Al(OH)3+OH-=AlO2-+2H2O;
③CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-;
④2Al(OH)3
Al2O3+3H2O,
故答案为::①Fe2O3+6H+=2Fe3++3H2O,Al2O3+6H+=2Al3++3H2O;
②Al(OH)3+OH-=AlO2-+2H2O;
③CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-;
④2Al(OH)3
Al2O3+3H2O;
(2)金属铝可以和氧化铁之间发生铝热反应,得到金属铁和氧化铝,即Fe2O3+2Al
Al2O3+2Fe,反应放热,生成的铁是熔融态,该反应可以用来焊接钢轨,故答案为:Fe2O3+2Al
Al2O3+2Fe;焊接钢轨.
| ||
①Fe2O3+6H+=2Fe3++3H2O,Al2O3+6H+=2Al3++3H2O;
②Al(OH)3+OH-=AlO2-+2H2O;
③CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-;
④2Al(OH)3
| ||
故答案为::①Fe2O3+6H+=2Fe3++3H2O,Al2O3+6H+=2Al3++3H2O;
②Al(OH)3+OH-=AlO2-+2H2O;
③CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-;
④2Al(OH)3
| ||
(2)金属铝可以和氧化铁之间发生铝热反应,得到金属铁和氧化铝,即Fe2O3+2Al
| ||
| ||
点评:本题以推断题的形式,考查金属及其化合物的相关性质.对此类题型的考查通常用结合铝及其化合物,解题的关键在于熟练掌握“铝三角”的相关反应,题目难度不大.

练习册系列答案
相关题目
已知:2Fe2++Br2=2Fe3++2Br-,若向100mL FeBr2溶液中缓慢通入2.24L标况下的氯气,充分反应后,有
的Br-被氧化成Br2,则原FeBr2溶液的物质的量浓度为( )
| 1 |
| 5 |
| A、1.4mol/L |
| B、2.5mol/L |
| C、无法计算 |
| D、5.0mol/L |
下列不需要用到二氧化硅的是( )
| A、光导纤维 | B、计算机芯片 |
| C、石英钟表 | D、普通玻璃 |
下列有关描述中,与事实相符的是( )
| A、Al(OH)3、CaCO3都难溶,但溶解的部分都能完全电离 |
| B、复盐是纯净物,而混盐(如CaOCl2)是混合物 |
| C、弱电解质溶液中有溶质分子,但强电解质溶液中难以存在溶质分子 |
| D、电解质溶液能够导电,是因为通电使电解质电离产生了自由移动的离子 |
在无色溶液中能大量共存的离子组是( )
| A、Ca2+、Cl-、CO32- |
| B、K+、Na+、SO42- |
| C、HCO3-、Na+、OH- |
| D、K+、Fe3+、SCN- |