题目内容
 实验室欲用NaOH固体配制1.0mol?L-1的NaOH溶液240mL.
实验室欲用NaOH固体配制1.0mol?L-1的NaOH溶液240mL.(1)配制溶液时,一般可以分为以下几个步骤:①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却其正确的操作顺序为
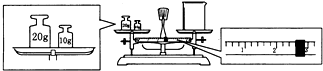
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为
(3)使用容量瓶前必须进行的一步操作是
(4)在配制过程中,某同学因某一步操作的失误导致所配溶液浓度总是偏高,试分析他可能的操作失误是
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(2)根据天平的称量原理;根据m=nM=cvM计算溶质NaOH的质量;
(3)使用容量瓶前必须进行的一步操作是检漏;
(4)根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断.
(2)根据天平的称量原理;根据m=nM=cvM计算溶质NaOH的质量;
(3)使用容量瓶前必须进行的一步操作是检漏;
(4)根据c=
| n |
| V |
解答:
解:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故答案为:②①③⑧⑤⑥⑦④;250mL容量瓶;
(2)因天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,所以烧杯的实际质量为30g-2.6g=27.4g,因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,NaOH的质量m=cvM=1.0mol?L-1×0.25L×40g/mol=10.0g;
故答案为:27.4;10.0;
(3)因使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水,故答案为:检查容量瓶是否漏水;
(4)操作失误导致所配溶液浓度偏高的因素很多:定容时俯视刻度线,溶液的体积偏小,浓度偏高;未冷却到室温就将溶液转移到容量瓶并定容,冷却下来溶液的体积偏小,浓度偏高;
故答案为:定容时俯视刻度线、未冷却到室温就将溶液转移到容量瓶并定容.
故答案为:②①③⑧⑤⑥⑦④;250mL容量瓶;
(2)因天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,所以烧杯的实际质量为30g-2.6g=27.4g,因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,NaOH的质量m=cvM=1.0mol?L-1×0.25L×40g/mol=10.0g;
故答案为:27.4;10.0;
(3)因使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水,故答案为:检查容量瓶是否漏水;
(4)操作失误导致所配溶液浓度偏高的因素很多:定容时俯视刻度线,溶液的体积偏小,浓度偏高;未冷却到室温就将溶液转移到容量瓶并定容,冷却下来溶液的体积偏小,浓度偏高;
故答案为:定容时俯视刻度线、未冷却到室温就将溶液转移到容量瓶并定容.
点评:本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
用已知浓度的盐酸滴定未知浓度的NaOH溶液会导致测得的NaOH溶液浓度偏高的是( )
| A、滴定前滴定管中有气泡,滴定后消失 |
| B、碱式滴定管量取NaOH溶液时,未进行润洗操作 |
| C、滴定时达到滴定终点时俯视读数 |
| D、锥形瓶取用NaOH待测液前加少量水洗涤 |
2011年3月28日,兰州某大学一实验室的实验装置发生爆炸并引起火灾.由此可见,注意安全措施非常重要.下列说法不正确的是( )
| A、做化学实验期间必须穿长袖、过膝的衣服,不准穿拖鞋,长发(过衣领)必须扎短或藏于帽内 |
| B、皮肤上不慎沾上浓硫酸要立即用氢氧化钠溶液冲洗 |
| C、绝对禁止向燃着的酒精灯里添加酒精 |
| D、熟悉常见危险化学品标志和污染物、废弃物的处理方法 |
蔗糖3.42g与麦芽糖3.42g混合后并完全水解,若生成m个葡萄糖分子与n 个果糖分子,则m与n的比值是( )
| A、1:3 | B、3:1 |
| C、1:2 | D、1:1 |
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )


| A、正四面体烷的二氯取代产物有2种 |
| B、正四面体烷与乙烯基乙炔互为同分异构体 |
| C、苯与环辛四烯互为同系物 |
| D、等质量的苯与环辛四烯完全燃烧消耗氧气量不相同 |
 某有机物的结构简式如图,它可能发生的反应类型有:①取代反应;②加成反应;③消去反应;④水解反应;⑤酯化反应;⑥中和反应;⑦氧化反应;⑧加聚反应.( )
某有机物的结构简式如图,它可能发生的反应类型有:①取代反应;②加成反应;③消去反应;④水解反应;⑤酯化反应;⑥中和反应;⑦氧化反应;⑧加聚反应.( )| A、①②③④⑥ |
| B、②③④⑥⑧ |
| C、①②③⑤⑥⑦ |
| D、③⑤⑥⑦⑧ |
将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
| A、K+、SiO32-、Cl-、NO3- |
| B、H+、NH4+、Al3+、SO42- |
| C、Na+、S2-、OH-、SO42- |
| D、Na+、C6H5O-、CH3COO-、HCO3- |
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.