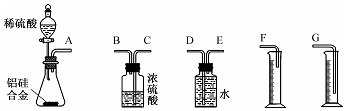
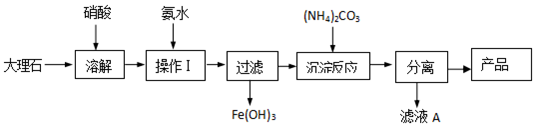
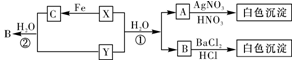
题目内容
15.1mol H2燃烧生成液态水时放出285.8kJ热量,下列表示该反应的热化学方程式正确的是( )| A. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 | |
| C. | 2H2+O2═2H2O△H=-571.6 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
分析 1mol H2燃烧生成液态水时放出285.8kJ热量,则焓变为负,结合物质的量与热量成正比及物质的状态来解答.
解答 解:1mol H2燃烧生成液态水时放出285.8kJ热量,则焓变为负,热化学方程式中需注明物质的状态,则B、C错误;
1mol H2燃烧生成液态水时放出285.8kJ热量,可知热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1或2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则A错误、D正确;
故选D.
点评 本题考查热化学方程式,为高频考点,把握焓变、物质的量与热量的关系、物质的状态为解答的关键,侧重分析与应用能力的考查,注意物质的量与热量成正比,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列关于漂白粉的叙述正确的是( )
| A. | 漂白粉的有效成分是Ca(ClO)2 | |
| B. | 漂白粉暴露在空气中久置不会变质 | |
| C. | 漂白粉是由Cl2与石灰乳制得 | |
| D. | 漂白粉变质过程中不涉及氧化还原反应 |
10. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟
雾产生.请分别写出a仪器和c仪器的名称:三颈(烧)瓶、球形冷凝管.
(2)请写出a中发生反应的化学方程式: .d中倒置漏斗的作用是:防倒吸,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型.试分析该同学的操作是否可行:否(填“是”或“否”),简要说明其原因:进入d烧杯被NaOH溶液吸收的除了HBr外还有Br2蒸汽,加入硝酸银仅能验证d中有溴离子,但是不能说明溴离子来自于HBr还是Br2.
.d中倒置漏斗的作用是:防倒吸,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型.试分析该同学的操作是否可行:否(填“是”或“否”),简要说明其原因:进入d烧杯被NaOH溶液吸收的除了HBr外还有Br2蒸汽,加入硝酸银仅能验证d中有溴离子,但是不能说明溴离子来自于HBr还是Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
雾产生.请分别写出a仪器和c仪器的名称:三颈(烧)瓶、球形冷凝管.
(2)请写出a中发生反应的化学方程式:
 .d中倒置漏斗的作用是:防倒吸,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型.试分析该同学的操作是否可行:否(填“是”或“否”),简要说明其原因:进入d烧杯被NaOH溶液吸收的除了HBr外还有Br2蒸汽,加入硝酸银仅能验证d中有溴离子,但是不能说明溴离子来自于HBr还是Br2.
.d中倒置漏斗的作用是:防倒吸,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型.试分析该同学的操作是否可行:否(填“是”或“否”),简要说明其原因:进入d烧杯被NaOH溶液吸收的除了HBr外还有Br2蒸汽,加入硝酸银仅能验证d中有溴离子,但是不能说明溴离子来自于HBr还是Br2.(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
20.反应A(g)+3B(g)=2C(g)+2D(g),不同情况下测得反应速率,其中反应速率最快的是( )
| A. | v(D)=0.4mol/(L•s) | B. | v(C)=30mol/(L•min) | C. | v(A)=0.15mol/(L•s) | D. | v(B)=0.9mol/(L•s) |
7.类推法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与 否.根据你所掌握的知识,判断下列类推结论中正确的是( )
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<Iz2 | 氢化物沸点:FH<HCI<HBr<HI |
| B | 用电解熔融MgCI2可制得金属 | 用电解熔融NaCI也可以制取金属钠 |
| C | 将CO:通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | AI与S加热时直接化合生成AI2S3 | Fe与S加热时也能直接化合生Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |
4.下列除杂方法正确的是( )
| A. | 乙烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气 | |
| B. | 乙烯中混有二氧化硫,将其通入氢氧化钠溶液中洗气 | |
| C. | 乙炔中混有硫化氢,将其通入溴水中洗气 | |
| D. | 溴苯中混有溴,加入汽油,振荡,用汽油萃取出溴 |