题目内容
20.反应A(g)+3B(g)=2C(g)+2D(g),不同情况下测得反应速率,其中反应速率最快的是( )| A. | v(D)=0.4mol/(L•s) | B. | v(C)=30mol/(L•min) | C. | v(A)=0.15mol/(L•s) | D. | v(B)=0.9mol/(L•s) |
分析 反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:反应速率与化学计量数的比值越大,反应速率越快,则
A.$\frac{0.4}{2}$=0.2;
B.$\frac{\frac{30}{60}}{2}$=0.25;
C.$\frac{0.15}{1}$=0.15;
D.$\frac{0.9}{3}$=0.3,
显然D中比值最大,反应速率最快,
故选D.
点评 本题考查反应速率的比较,为高频考点,把握反应速率与化学计量数成正比为解答的关键,侧重分析与计算能力的考查,注意比值法应用及速率单位要统一,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列有关的叙述正确的是( )
| A. | CO2水溶液能够导电,所以CO2是电解质 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | 根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 | |
| D. | “血液透析”原理与胶体的性质无关 |
10.下列关于物质的量的叙述正确的是( )
| A. | 1molNa2CO3约含有6.02×1023个Na2CO3分子 | |
| B. | 2molH2O的摩尔质量为36g/mol | |
| C. | 标准状况下,22.4LCH4含有的电子数为10NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
8.下列实验现象描述不正确的是
| 实验 | 现象 | |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球.燃烧时,火焰为黄色;燃烧后,生成淡黄色的固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔并不滴落,好像有一层膜兜着 |
| C | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| D | 镁条在CO2中燃烧 | 剧烈燃烧,放出大量的热,产生耀眼白光,生成白色固体和黑色颗粒 |
| A. | A | B. | B | C. | C | D. | D |
15.1mol H2燃烧生成液态水时放出285.8kJ热量,下列表示该反应的热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 | |
| C. | 2H2+O2═2H2O△H=-571.6 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有分子数为NA | |
| B. | 分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g | |
| C. | 4 g金属钙变成钙离子时失去的电子数目为0.1 NA | |
| D. | 常温常压下,1.6 g CH4含原子数为0.5NA |
10.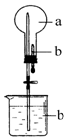 在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
 在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )| A. | NO2和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | H2、O2混合气体与饱和食盐水 |
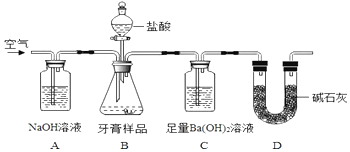 化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究: