题目内容
13.元素周期表中ⅦA族元素的单质及其化合物的用途广泛.(1)与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是2p;
(2)碘元素在元素周期表中的位置是第五周期ⅦA族;为防缺碘,食盐中常添加碘酸钾,该物质内存在离子键、共价键键(填化学键类型).
(3)溴单质是唯一常温下呈液态的非金属单质,它的电子式是
 ;液溴的保存通常采取的方法是水封在棕色瓶中,密闭保存.
;液溴的保存通常采取的方法是水封在棕色瓶中,密闭保存.(4)通过比较HCl和HBr的气态氢化物的热稳定性或HClO4和HBrO4的酸性可以判断氯、溴两种元素非金属性强弱.
(5)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体
①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl+□H2O $\stackrel{80℃,通电}{→}$□NaClO3+□

②II反应过程能析出KClO3晶体而无其它晶体析出的原因是室温下,氯酸钾在水中的溶解度明显小于其它晶体.
(6)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是4CuCl(s)+O2(g)=2CuO(s)+2CuCl2(s)△H=-177.6kJ/mol.
分析 (1)与氯元素同族的短周期元素原子为F,再根据核外电子排布规律来分析即可;
(2)碘元素第五周期的卤族元素;碘酸钾是含有共价键的离子化合物;
(3)溴单质中原子之间形成一个共用电子对;液溴易挥发,而挥发性的物质用水封在棕色瓶中密闭保存;
(4)氢化物的稳定性越强、最高价氧化物水化物的酸性越强,则非金属性越强;
(5)①电解氯化钠溶液,阳极上氯离子失去电子生成氯酸根离子,发生氧化反应,阴极氢离子得到电子发生还原反应生成氢气,依据化合价升级数相同配平方程式;
②相同温度下,溶解度小的物质先析出;
(6)发生反应:4CuCl+O2=2CuO+2CuCl2,计算4molCuCl反应放出的热量,注明物质聚集状态与反应热书写热化学方程式.
解答 解:(1)解:与氯元素同族的短周期元素原子为F,核外有9个电子,核外电子排布式为:F:1s22s22p5,能量最高的电子所处的电子亚层是2p,
故答案为:2p;
(2)碘元素第五周期的卤族元素;碘酸钾中碘酸根离子与钾离子之间为离子键,碘酸根离子中I与O之间为共价键,
故答案为:第五周期ⅦA族;离子键、共价键;
(3)溴单质中原子之间形成一个共用电子对,其电子式为 ;见光易分解放在棕色瓶中和易挥发的物质用水封在棕色瓶中,密闭保存,
;见光易分解放在棕色瓶中和易挥发的物质用水封在棕色瓶中,密闭保存,
故答案为: ;水封在棕色瓶中,密闭保存;
;水封在棕色瓶中,密闭保存;
(4)氢化物的稳定性越强,则非金属性越强,所以通过比较HCl和HBr的气态氢化物的热稳定性可以判断非金属性强弱;最高价氧化物水化物的酸性越强,则非金属性越强,所以通过比较HClO4和HBrO4的酸性可以判断非金属性强弱.
故答案为:HCl和HBr的气态氢化物的热稳定性;HClO4和HBrO4的酸性;
(5)①电解氯化钠溶液,阳极上氯离子失去电子生成氯酸根离子,发生氧化反应,阴极氢离子得到电子发生还原反应生成氢气,依据化合价升级数相同配平方程式:NaCl+3H2O=NaClO3+3H2↑;
反应中,氯离子失去6e-生成氯酸根离子,电子转移的方向和数目为: ;
;
故答案为: ;
;
②NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3;
故答案为:室温下,氯酸钾在水中的溶解度明显小于其它晶体
(6)发生反应:4CuCl+O2=2CuO+2CuCl2,4molCuCl反应放出的热量为44.4kJ×4=177.6kJ,反应热化学方程式为:4CuCl(s)+O2(g)=2CuO(s)+2CuCl2(s)△H=-177.6kJ/mol,
故答案为:4CuCl(s)+O2(g)=2CuO(s)+2CuCl2(s)△H=-177.6kJ/mol.
点评 本题考查了化学键、电子式、氧化还原反应方程式书写,注意氧化还原方程式中化合价升级数相等、非金属元素的非金属性强弱比较方法,侧重于考查学生对基础知识的应用能力,题目难度中等.

| A. | 过量的NaOH与Ca(HCO3)2反应:2OH-+Ca2++2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- | |
| D. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+=2Fe3++3H2O |
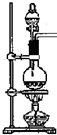
| A. | 利用浓硫酸的吸水性和氧化性 | |
| B. | 开始制备气体时应先加热后向烧瓶中加硫酸 | |
| C. | 利用浓硫酸的难挥发性和酸性 | |
| D. | 组装完实验装置立即加试剂、加热制气体 |
| A. | 对因胃酸过多而导致胃部严重溃疡的病人不可使用含有碳酸氢钠的药物治疗 | |
| B. | 淀粉、纤维素水解的最终产物都是葡萄糖 | |
| C. | 误食了重金属离子,应立即喝大量牛奶来缓解毒性 | |
| D. | R表示非处方药,OTC表示处方药 |
①可以用电解熔融的氯化钠的方法来制取金属钠.
②可以用钠加入氯化镁饱和溶液中制取镁.
③用电解法制铝时,原料是氯化铝.
④炼铁高炉中所发生的反应都是放热的,故无需加热.
| A. | ② | B. | ②③ | C. | ①②③ | D. | ②③④ |
| A. | 加热 | |
| B. | 滴加少量的CuSO4溶液 | |
| C. | 不用稀硫酸,改用更多的18mol/L硫酸溶液 | |
| D. | 不用铁片,改用铁粉 |
| A. | 稀硫酸 | B. | 水 | C. | 溴水 | D. | 酸性高锰酸钾 |
| A. | SO32- | B. | SO42- | C. | S | D. | H2S |