题目内容
7.下列有关热化学方程式的书写及对应的表达均正确的是( )| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量,则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
分析 A、依据n=$\frac{m}{M}$计算物质的量结合热化学方程式的意义分析判断;
B、醋酸是弱酸存在电离平衡,电离过程是吸热过程;
C、反应的焓变和化学方程式中物质的量有关;
D、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析.
解答 解:A、密闭容器中,9.6g硫粉物质的量为0.3mol,与11.2g铁粉物质的量为0.2mol混合加热生成硫化亚铁17.6g时,硫过量,放出19.12kJ热量,所以1mol铁反应放热=19.12KJ×$\frac{1}{0.2}$=95.6KJ,热化学方程式为Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1 ,故A正确;
B、稀醋酸是弱酸电离过程是吸热过程,与0.1mol•L-1NaOH溶液反应放出的热量小于中和热,焓变是负值则:H+(aq)+OH-(aq)═H2O(l)△H>-57.3kJ•mol-1,故B错误;
C、1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+571kJ.mol-1,故C错误;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,碳燃烧生成的一氧化碳不是稳定氧化物,故D错误;
故选A.
点评 本题考查了化学反应能量变化,热化学方程式书写,燃烧热,中和热放热概念分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.配制250mL0.1mol•L-1的NaCl溶液时,下列实验操作会使所配溶液浓度偏大的是( )
| A. | 定容时俯视刻度线 | |
| B. | 移液前容量瓶不干燥 | |
| C. | 定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,再补几滴蒸馏水 | |
| D. | 溶解所称NaCl并移液后,用蒸馏水洗涤烧杯2~3次,洗涤液转移至容量瓶中 |
15.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象的说法正确的是( )
| A. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| D. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
12.某单烯烃和氢气加成之后的产物是“2-甲基戊烷”,则原烯烃的结构有多少种?( )
| A. | 4 | B. | 5 | C. | 7 | D. | 8 |
19.下列反应描述错误的是( )
| A. | Cu与过量浓HNO3反应,生成的气体呈红棕色 | |
| B. | 足量H2通过灼热的CuO粉末后,生成的固体为红色 | |
| C. | AgNO3溶液与足量Na2S溶液反应后再滴加NaCl溶液,沉淀为白色 | |
| D. | 物质的量相同的CH3COOH与NaOH反应后滴加酚酞,溶液显红色 |
17.(1)CO2经过催化氢化可合成低碳烯烃.
其合成乙烯的反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g);△H. 几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
则△H=-128kJ/mol
(2)以稀硫酸为电解质溶液,利用太阳能也可将CO2转化为低碳烯烃,工作原理图如图1.

①b电极的名称是正极.②产生丙烯的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
(3)工业上采用CO2与乙苯脱氢生产重要化工原料苯乙烯,反应如下:
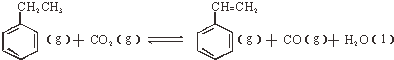 ;△H<0
;△H<0
①下列叙述能说明乙苯与CO2反应已达到平衡状态的是ad.
a.恒温恒压时气体密度不变b.c(CO2)=c(CO)
c.消耗1mol CO2同时生成 1mol H2O
d.CO2的体积分数保持不变
②在2L密闭容器内,CO2与乙苯发生反应.在三种不同的条件下进行实验,CO2、乙苯的起始浓度均分别为3mol/L和1mol/L,其中实验I在T1°C、P1 Pa下,而实验Ⅱ、Ⅲ分别改变了某一个实验条件(假设均不影响物质的状态),乙苯的浓度随时间的变化如图2所示.则:实验ⅠCO2在0-50min时的反应速率为0.012mol/(L•min).
实验Ⅲ可能改变的条件是升高温度.
③实验Ⅰ达到平衡后,在该温度下,向该容器中再通入CO2和乙苯各1mol,重新达到平衡时,乙苯的转化率将减少(填“增大”、“减小”或“不变”),此时平衡常数为0.375.
其合成乙烯的反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g);△H. 几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
| 物质 | H2(g) | CO2(g) | CH2=CH2 | H2O(g) |
| 能量:KJ/mol | 0 | -394 | 52 | -242 |
(2)以稀硫酸为电解质溶液,利用太阳能也可将CO2转化为低碳烯烃,工作原理图如图1.

①b电极的名称是正极.②产生丙烯的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
(3)工业上采用CO2与乙苯脱氢生产重要化工原料苯乙烯,反应如下:
 ;△H<0
;△H<0①下列叙述能说明乙苯与CO2反应已达到平衡状态的是ad.
a.恒温恒压时气体密度不变b.c(CO2)=c(CO)
c.消耗1mol CO2同时生成 1mol H2O
d.CO2的体积分数保持不变
②在2L密闭容器内,CO2与乙苯发生反应.在三种不同的条件下进行实验,CO2、乙苯的起始浓度均分别为3mol/L和1mol/L,其中实验I在T1°C、P1 Pa下,而实验Ⅱ、Ⅲ分别改变了某一个实验条件(假设均不影响物质的状态),乙苯的浓度随时间的变化如图2所示.则:实验ⅠCO2在0-50min时的反应速率为0.012mol/(L•min).
实验Ⅲ可能改变的条件是升高温度.
③实验Ⅰ达到平衡后,在该温度下,向该容器中再通入CO2和乙苯各1mol,重新达到平衡时,乙苯的转化率将减少(填“增大”、“减小”或“不变”),此时平衡常数为0.375.
 ⑤
⑤


 _.
_. D.
D. E.
E.