题目内容
18.二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图1有些支持装置省略了)所示.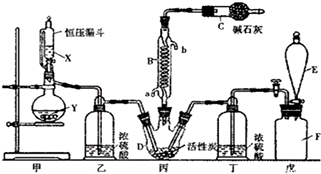
图1
已知:SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,产物之一为氯化氢气体.
(1)E中的试剂是饱和食盐水,戊是贮气装置,则F瓶中气体的实验室制法是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O(用方程式表示);
(2)B处反应管冷却水应从a(填“a”或“b”)接口通入;
(3)装置乙和丁的作用是干燥SO2和Cl2,防止SO2Cl2发生水解反应;
(4)恒压漏斗具有特殊的结构,主要目的是使所加的液体能顺利滴入烧瓶中;
(5)写出二氯化砜(SO2Cl2)水解反应的方程式SO2Cl2+H2O=H2SO4+2HCl;
(6)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸,选用下面的如图2装置和药品探究亚硫酸与次氯酸的酸性性强弱,装置连接顺序为A、C、B,E,D,F,其中装置C的作用是吸收HCl,通过D中品红不褪色,F中出现白色沉淀现象即可证明亚硫酸的酸性强于次氯酸.
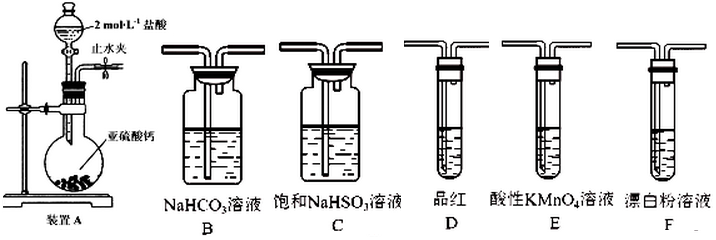
图2.
分析 实验室可利用SO2与Cl2反应制取少量的SO2Cl2,则丙中SO2与Cl2反应制取少量的SO2Cl2,甲为制取气体装置,E中的试剂是饱和食盐水,戊是贮气装置,则F装置是除去氯气中的氯化氢,丁中浓硫酸干燥氯气;
甲为制取二氧化硫装置,用亚硫酸钠和浓硫酸制取二氧化硫,乙装置干燥二氧化硫,因为SO2Cl2的熔点为-54.1℃,沸点为69.1℃,所以丙中连接冷凝管,C中碱石灰吸收二氧化硫、氯气,防止污染空气;
(1)F瓶中气体是氯气,实验室用浓盐酸和二氧化锰加热制取氯气;
(2)B处反应管冷却水采用逆流方法;
(3)浓硫酸具有吸水性,能作气体干燥剂;
(4)因为A装置是不连接空气,将生成的气体进入恒压漏斗而产生压力,从而使恒压漏斗中液体流下;
(5)二氯化砜(SO2Cl2)水解生成硫酸和HCl;
(6)次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断.A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中.
解答 解:实验室可利用SO2与Cl2反应制取少量的SO2Cl2,则丙中SO2与Cl2反应制取少量的SO2Cl2,甲为制取气体装置,E中的试剂是饱和食盐水,戊是贮气装置,则F装置是除去氯气中的氯化氢,丁中浓硫酸干燥氯气;
甲为制取二氧化硫装置,用亚硫酸钠和浓硫酸制取二氧化硫,乙装置干燥二氧化硫,因为SO2Cl2的熔点为-54.1℃,沸点为69.1℃,所以丙中连接冷凝管,C中碱石灰吸收二氧化硫、氯气,防止污染空气;
(1)F瓶中气体是氯气,实验室用浓盐酸和二氧化锰加热制取氯气,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B处反应管冷却水采用逆流方法,则a为进水口、b为出水口,故答案为:a;
(3)浓硫酸具有吸水性,能作气体干燥剂,所以浓硫酸是干燥SO2和 Cl2,防止SO2Cl2发生水解反应,故答案为:干燥SO2和 Cl2,防止SO2Cl2发生水解反应;
(4)因为A装置是不连接空气,将生成的气体进入恒压漏斗而产生压力,从而使恒压漏斗中液体流下,所以恒压漏斗结构特点目的是使所加的液体能顺利滴入烧瓶中,故答案为:使所加的液体能顺利滴入烧瓶中
;
(5)二氯化砜(SO2Cl2)水解生成硫酸和HCl,反应方程式为SO2Cl2+H2O=H2SO4+2HCl,
故答案为:SO2Cl2+H2O=H2SO4+2HCl;
(6)次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断.A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,则:
装置连接顺序为A、C、B、E、D、F,其中装置C的作用是除去HCl气体,D中品红不褪色,F中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸,
故答案为:B、E;除去HCl气体;D中品红不褪色,F中出现白色沉淀.
点评 本题考查物质制备及性质实验方案设计,为高频考点,明确实验原理、物质性质是解本题关键,侧重考查学生实验操作、分析评价能力,注意(6)题解答,很多同学往往利用强酸制取弱酸来连接装置而导致错误,注意次氯酸和二氧化硫能发生氧化还原反应,为易错点.

 灵星计算小达人系列答案
灵星计算小达人系列答案| A. | 120° | B. | 104°30′ | C. | 109°28′ | D. | 60° |
| A. | 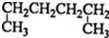 1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 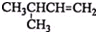 3-甲基丁烯 3-甲基丁烯 | ||
| C. | 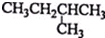 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
| A. |  二溴乙烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. |  2-羟基丁烷 | D. |  2,3-二甲基-1,4-戊二烯 |
| A. | 1,3?二甲基戊烷 | B. | 2?甲基??3 乙基丁烷 | ||
| C. | 3,4?二甲戊烷 | D. | 2,3?二甲基戊烷 |
| A. | NH4++OH-→NH3•H2O | B. | 2Na+2H2O→2Na++2OH-+H2↑ | ||
| C. | HCO3-+OH-→H2O+CO32- | D. | 2Na+2H2O→2NaOH+H2↑ |
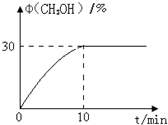 CO2加氢合成甲醇的技术,对减少温室气体排放和减缓燃料危机具有重要意义,发生的主要反应如下:CO2(g)+3H2(g)═CH3OH(g)+H2O(g).回答下列问题:
CO2加氢合成甲醇的技术,对减少温室气体排放和减缓燃料危机具有重要意义,发生的主要反应如下:CO2(g)+3H2(g)═CH3OH(g)+H2O(g).回答下列问题: