题目内容
7.向含有1摩碳酸氢铵的溶液中加入1摩金属钠,可能发生反应的离子方程式是( )| A. | NH4++OH-→NH3•H2O | B. | 2Na+2H2O→2Na++2OH-+H2↑ | ||
| C. | HCO3-+OH-→H2O+CO32- | D. | 2Na+2H2O→2NaOH+H2↑ |
分析 钠与水先反应生成氢氧化钠和氢气,氢氧化钠再与碳酸氢根离子反应生成碳酸根离子和水,据此解答.
解答 解:向含有1摩碳酸氢铵的溶液中加入1摩金属钠,钠与水先反应生成氢氧化钠和氢气,化学方程式:2Na+2H2O→2NaOH+H2↑,离子方程式:2Na+2H2O→2Na++2OH-+H2↑,反应生成1mol氢氧化钠,氢氧化钠少量,所以氢氧化钠再与碳酸氢根离子反应生成碳酸根离子和水,离子方程式:HCO3-+OH-→H2O+CO32-,
故选:BC.
点评 本题考查了离子方程式的书写,解题时注意钠与盐溶液反应实质先与水反应,生成的氢氧化钠再与碳酸氢根离子和铵根离子反应,氢氧化钠少量,先与碳酸氢根离子反应,题目难度中等.

练习册系列答案
相关题目
2.下列实验目的可以达到的是( )
| A. | 漂白粉与浓盐酸反应可制取氯气 | |
| B. | 用FeS与稀硝酸制取硫化氢 | |
| C. | 浓硫酸与碘化钠共热制取碘化氢 | |
| D. | 用浓溴水除去苯中溶有的少量的苯酚 |
12.下列离子方程式的书写正确的是( )
| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-→Cl2↑+Mn2++H2O | |
| B. | 将标准状况下1.12 L氯气通入10 mL 1 mol/L的溴化亚铁溶液中:2Fe2++4Br-+3Cl2→2Fe3++6Cl-+2Br2 | |
| C. | 向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O | |
| D. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+→BaSO4↓+NH3•H2O+H2O |
19.某元素的原子,L层电子数是M层电子数的2倍,该元素是( )
| A. | Mg | B. | C | C. | Si | D. | S |
16.25℃、101kPa下:
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414kJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol
下列说法不正确的是( )
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414kJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol
下列说法不正确的是( )
| A. | ①和②产物的阴阳离子个数比相等,均为1:2 | |
| B. | ①和②生成等物质的量的产物,转移电子数相同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101 kPa下,Na2O2(s)+2Na(s)═2Na2O(s)△H=-317 kJ/mol |
17.下列反应中硫酸既不表现氧化性且又不表现还原性的是( )
| A. | 2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑ | |
| B. | 2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O | |
| C. | H2SO4(稀)+Zn═ZnSO4+H2↑ | |
| D. | H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
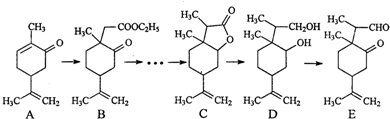
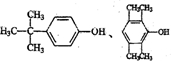 (任写一种).
(任写一种).
 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 中有氧官能团的名称为醛基.
中有氧官能团的名称为醛基.