题目内容
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐操作A①BaCl2②NaOH③Na2CO3④操作B⑤滤液适量盐酸⑥蒸发、结晶、烘干⑦粗盐
(1)第①步中,操作A是 ,第⑤步中,操作B是 .
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2) .
(3)若第②步加Na2CO3,第④步加BaCl2,将对实验结果产生影响,其原因是 .
称取粗盐操作A①BaCl2②NaOH③Na2CO3④操作B⑤滤液适量盐酸⑥蒸发、结晶、烘干⑦粗盐
(1)第①步中,操作A是
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(3)若第②步加Na2CO3,第④步加BaCl2,将对实验结果产生影响,其原因是
考点:粗盐提纯
专题:实验题
分析:(1)在粗盐提纯之前要先将粗盐溶解于水中,实现固体和液体的分离方法是过滤;
(2)在粗盐提纯时,可以加入碳酸钠除去钙离子和过量的钡离子,应放在氯化钡的后面加;
(3)碳酸钠可以除去钙离子和多余的钡离子,如果第②步加Na2CO3,第④步加BaCl2,则只能除掉钙离子,不能除掉过量的钡离子.
(2)在粗盐提纯时,可以加入碳酸钠除去钙离子和过量的钡离子,应放在氯化钡的后面加;
(3)碳酸钠可以除去钙离子和多余的钡离子,如果第②步加Na2CO3,第④步加BaCl2,则只能除掉钙离子,不能除掉过量的钡离子.
解答:
解:(1)在粗盐提纯之前要先将粗盐溶解于水中,第①步中,操作A是溶解,第⑤步中的操作是实现固体和液体的分离方法,即过滤,
故答案为:溶解;过滤;
(2)在粗盐提纯时,可以加入碳酸钠除去钙离子和过量的钡离子,发生的反应方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,
故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl;
(3)碳酸钠可以除去钙离子和多余的钡离子,如果第②步加Na2CO3,第④步加BaCl2,则只能除掉钙离子,不能除掉过量的钡离子,
故答案为:溶液中还有BaCl2溶液未除去.
故答案为:溶解;过滤;
(2)在粗盐提纯时,可以加入碳酸钠除去钙离子和过量的钡离子,发生的反应方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,
故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl;
(3)碳酸钠可以除去钙离子和多余的钡离子,如果第②步加Na2CO3,第④步加BaCl2,则只能除掉钙离子,不能除掉过量的钡离子,
故答案为:溶液中还有BaCl2溶液未除去.
点评:本题主要考查学生除杂质的原则以及除杂质的顺序,难度不大,掌握碳酸钠的作用以及沉淀的性质是解题的关键.

练习册系列答案
相关题目
MgCl2、KCl、K2SO43种盐配成混合液后,若溶液中n(K+)=1.5mol、n(Mg2+)=0.5mol、n(Cl-)=1.5mol,则溶液中n(SO42-)应为( )
| A、0.5 mol |
| B、0.25 mol |
| C、0.15 mol |
| D、1 mol |
往AlCl3溶液中逐滴滴入NaOH溶液至过量,可观察到的现象是( )
| A、有白色絮状沉淀产生,且不溶解 |
| B、先无现象,后有白色絮状沉淀 |
| C、一直无明显现象 |
| D、先有白色絮状沉淀,后又溶解 |
在无色透明的溶液中可以大量共存的离子组是( )
| A、H+、K+、Fe2+、NO3- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Cu2+、NO3-、OH-、Cl- |
| D、Mg2+、K+、Cl-、NO3- |
下列化学变化中,相关示意图错误的是( )
A、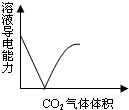 CO2通入澄清石灰水 |
B、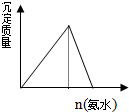 明矾中加入氨水 |
C、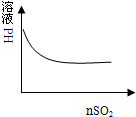 氯水中通入SO2 |
D、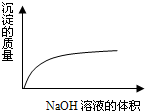 NaOH溶液滴入Ba(HCO3)2溶液 |
 硫元素有多种化合价,可形成多种化合物.
硫元素有多种化合价,可形成多种化合物.