题目内容
MgCl2、KCl、K2SO43种盐配成混合液后,若溶液中n(K+)=1.5mol、n(Mg2+)=0.5mol、n(Cl-)=1.5mol,则溶液中n(SO42-)应为( )
| A、0.5 mol |
| B、0.25 mol |
| C、0.15 mol |
| D、1 mol |
考点:物质的量的相关计算
专题:
分析:根据溶液中的阴阳离子的电荷总数相等,即溶液中的阳离子带电的电荷量与阴离子所带电电荷量相等.
解答:
解:溶液中阴离子和阳离子的正负电荷总数相等,即1×n(K+)+2×n( Mg2+)=1×n(Cl-)+2×n(SO42-),
所以1×1.5mol+2×0.5mol=1×1.5mol+2n(SO42-),
解得n(SO42-)=0.5mol,
故选A.
所以1×1.5mol+2×0.5mol=1×1.5mol+2n(SO42-),
解得n(SO42-)=0.5mol,
故选A.
点评:本题考查电荷守恒,溶液中阴离子和阳离子的正负电荷守恒是解决溶液中离子浓度的一种简便方法,注意灵活应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关物质的性质与应用相对错误的是( )
| A、氧化铝熔点高,因此可用作耐高温材料 |
| B、氢氟酸能与二氧化碳反应,因此可用于刻蚀玻璃 |
| C、碳化硅硬度大,因此可用作磨料 |
| D、碳酸钡能与盐酸反应,因此可用于治疗胃酸过多 |
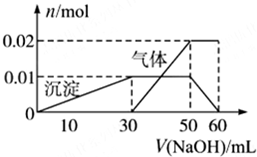 某无色溶液中含有NH4+、K+、Al3+、SO42-四种离子,进行如下实验:
某无色溶液中含有NH4+、K+、Al3+、SO42-四种离子,进行如下实验:(1)取10mL该溶液于试管中并滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀;
(2)取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解.并且随NaOH溶液的加入,沉淀和气体的变化关系如图所示.下列说法不符合事实的是( )
| A、根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L |
| B、根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L |
| C、另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42-同时完全沉淀 |
| D、NH4+、K+、Al3+、SO42-四种离子的物质的量之比为:2:1:1:3 |
下列实验操作中,错误的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、用100 mL容量瓶配制90mL1mol/L的NaOH溶液 |
| C、用pH试纸测得新制氯水的pH为2 |
| D、用酸式滴定管准确量取10.00mLKMnO4溶液 |
向KAl(SO4)2溶液中加入Ba(OH)2溶液,当SO42-恰好沉淀完全时,这时铝元素的存在形式是( )
| A、Al(OH)3沉淀 |
| B、只有[Al(OH)4]- |
| C、Al(OH)3沉淀和Al3+ |
| D、Al(OH)3沉淀和[Al(OH)4]- |
 二氧化硅晶体是立体的网状结构.其晶体模型如图所示.认真观察晶体模型并回答下列问题:
二氧化硅晶体是立体的网状结构.其晶体模型如图所示.认真观察晶体模型并回答下列问题: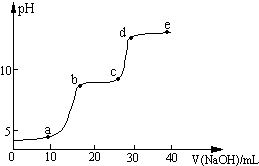 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol?L-1 MgSO4、0.05mol?L-1 Al2(SO4)3的混合溶液中滴加0.5mol?L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol?L-1 MgSO4、0.05mol?L-1 Al2(SO4)3的混合溶液中滴加0.5mol?L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.


