题目内容
下列有关化学用语表示正确的是( )
A、H2S的电子式: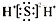 |
B、基态氧原子的电子排布图: |
| C、二氧化硅的分子式:SiO2 |
| D、24Cr的电子排布式:[Ar]3d54s1 |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.硫化氢为共价化合物,电子式中不需要标出所带电荷;
B.根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同是,能量最低,根据此原则进行判断;.
C.SiO2为二氧化硅的化学式,二氧化硅中不存在分子;
D.根据构造原理写出24Cr的电子排布式.
B.根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同是,能量最低,根据此原则进行判断;.
C.SiO2为二氧化硅的化学式,二氧化硅中不存在分子;
D.根据构造原理写出24Cr的电子排布式.
解答:
解:A.硫化氢属于共价化合物,其分子中存在两个硫氢共价键,硫化氢正确的电子式为: ,故A错误;
,故A错误;
B.由于简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,原子的能量最低,O原子能量最低排布图为: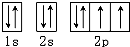 ,故B错误;
,故B错误;
C.二氧化硅晶体为原子晶体,晶体中不存在二氧化硅分子,SiO2为二氧化碳的化学式,故C错误;
D.24Cr的核外含有24个电子,根据构造原理其电子排布式为:[Ar]3d54s1,故D正确;
关系D.
 ,故A错误;
,故A错误;B.由于简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,原子的能量最低,O原子能量最低排布图为:
 ,故B错误;
,故B错误;C.二氧化硅晶体为原子晶体,晶体中不存在二氧化硅分子,SiO2为二氧化碳的化学式,故C错误;
D.24Cr的核外含有24个电子,根据构造原理其电子排布式为:[Ar]3d54s1,故D正确;
关系D.
点评:本题考查了电子排布图、电子式、分子式与化学式、核外电子排布式等知识,题目难度中等,注意掌握常见化学用语的概念及表示方法,明确离子化合物与共价化合物的电子式的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、在标准状况下,11.2 L H2O中含有的分子数为0.5 NA |
| B、32 g O2所含的原子数为2 NA |
| C、1 mol/L NaCl溶液中含有的Na+的数为NA |
| D、1 mol Na2O2中离子总数为4 NA |
25℃时,0.01mol/L的稀盐酸溶液中水电离出的H+的浓度是( )
| A、5×10-13mol/L |
| B、0.01 mol/L |
| C、1×10-7 mol/L |
| D、1×10-12mol/L |
已知25℃、101kPa条件下:3O2(g)=2O3(g)△H=+284.2kJ?mol-1下列说法正确的是( )
| A、等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B、等质量的O2比O3能量高,由O2变O3为放热反应 |
| C、O3比O2稳定,由O2变O3为吸热反应 |
| D、O2比O3稳定,由O2变O3为放热反应 |
下列化合物中,既含有离子键又含有共价键的是( )
| A、HBr |
| B、CO2 |
| C、CaCl2 |
| D、NaOH |
下列有关化学用语表达正确的是( )
| A、二氧化硅的分子式:SiO2 |
B、H2O2的电子式: |
C、乙酸分子的球棍模型: |
D、离子结构示意图  可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
已知电离平衡常数:Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3),还原性:I->Fe2+>Br-.下列有关判断不正确的是( )
| A、FeCl3溶液滴入KI淀粉溶液后,溶液变蓝 |
| B、纯碱溶液中滴入少量氯水后生成次氯酸、氯化钠等 |
| C、NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3- |
| D、向FeI2溶液中滴加少量溴水,反应的离子方程式为:2I-+Br2=I2+2Br- |
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-.现取该溶液进行有关实验,实验结果如图所示:
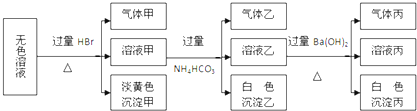
下列说法正确的是( )

下列说法正确的是( )
| A、沉淀甲可能是AgBr |
| B、沉淀丙一定是BaCO3 |
| C、气体甲的成份只有4种可能 |
| D、肯定存在的离子有AlO2-、S2-、SO32-、Na+ |
 是一种新型可生物降解的高分子材料,主要用于制造可降解纤维,可降解塑料和医用材料.它以淀粉为原料,先水解为葡萄糖,再在乳酸菌的作用下降葡萄糖转变为乳酸
是一种新型可生物降解的高分子材料,主要用于制造可降解纤维,可降解塑料和医用材料.它以淀粉为原料,先水解为葡萄糖,再在乳酸菌的作用下降葡萄糖转变为乳酸 ,乳酸在催化剂的催化下聚合成聚乳酸.聚乳酸材料废弃后,先水解成乳酸,乳酸在微生物的作用下分解为CO2和H2O.请用化学方程式表示上述聚合与降解的过程.
,乳酸在催化剂的催化下聚合成聚乳酸.聚乳酸材料废弃后,先水解成乳酸,乳酸在微生物的作用下分解为CO2和H2O.请用化学方程式表示上述聚合与降解的过程.