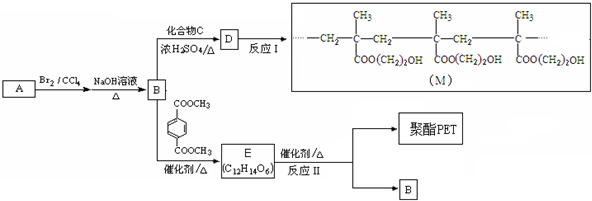
题目内容
已知电离平衡常数:Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3),还原性:I->Fe2+>Br-.下列有关判断不正确的是( )
| A、FeCl3溶液滴入KI淀粉溶液后,溶液变蓝 |
| B、纯碱溶液中滴入少量氯水后生成次氯酸、氯化钠等 |
| C、NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3- |
| D、向FeI2溶液中滴加少量溴水,反应的离子方程式为:2I-+Br2=I2+2Br- |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、还原性I->Fe2+,则氧化性Fe3+>I2,据此分析;
B、氯水中有盐酸和次氯酸,盐酸能够与碳酸钠反应生成氯化钠水和二氧化碳,次氯酸能够与碳酸钠反应生成碳酸氢钠和次氯酸钠;
C、向NaClO溶液中通入少量二氧化碳,生成HClO和HCO3-;
D、向FeI2溶液中滴加少量氯水,只氧化I-.
B、氯水中有盐酸和次氯酸,盐酸能够与碳酸钠反应生成氯化钠水和二氧化碳,次氯酸能够与碳酸钠反应生成碳酸氢钠和次氯酸钠;
C、向NaClO溶液中通入少量二氧化碳,生成HClO和HCO3-;
D、向FeI2溶液中滴加少量氯水,只氧化I-.
解答:
解:A、氧化性Fe3+>I2,所以FeCl3溶液滴入KI淀粉溶液后铁离子能够氧化碘离子生成碘单质遇淀粉变蓝,故A正确;
B、纯碱溶液中滴入少量氯水后不会生成次氯酸,故B错误;
C、向NaClO溶液中通入少量二氧化碳,生成HClO和HCO3-,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,故C正确;
D、向FeI2溶液中滴加少量氯水,只氧化I-,反应的离子方程式为:2I-+Cl2═I2+2Cl-,故D正确;
故选B.
B、纯碱溶液中滴入少量氯水后不会生成次氯酸,故B错误;
C、向NaClO溶液中通入少量二氧化碳,生成HClO和HCO3-,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,故C正确;
D、向FeI2溶液中滴加少量氯水,只氧化I-,反应的离子方程式为:2I-+Cl2═I2+2Cl-,故D正确;
故选B.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,侧重于学生的分析能力的考查,明确发生的离子反应及离子反应方程式的书写方法即可解答,注意把握离子的性质,难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
下列化合物中属于共价化合物的是( )
| A、NaCl |
| B、NaOH |
| C、CH4 |
| D、(NH4)2SO4 |
下列有关化学用语表示正确的是( )
A、H2S的电子式: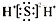 |
B、基态氧原子的电子排布图: |
| C、二氧化硅的分子式:SiO2 |
| D、24Cr的电子排布式:[Ar]3d54s1 |
下列化学用语正确的是( )
| A、H2O的结构式:H-O-H |
| B、乙醇的结构简式:C2H6O |
C、H2O2的电子式: |
D、14C的原子结构示意图: |
下列有机物用于合成聚乙烯塑料,是聚乙烯的单体的是( )
| A、CH4 |
| B、CH2=CH2 |
| C、CH3CH2OH |
| D、CH2=CHCH3 |
某固体粉末X中可能含有FeO、Fe2O3、MnO2、K2S、K2SO3、KAlO2、MgCl2、K2SO4、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下: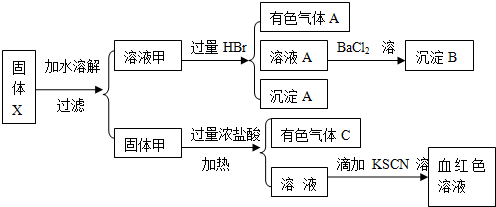 根据上述实验,以下说法正确的是( )
根据上述实验,以下说法正确的是( )
 根据上述实验,以下说法正确的是( )
根据上述实验,以下说法正确的是( )| A、原混合物中一定不含有MgCl2 |
| B、气体A的成分可能超过2种 |
| C、溶液甲中一定含有Na2SiO3、NaNO2、K2SO4可能含有K2CO3、K2SO3 |
| D、固体甲中除MnO2外,可能只含有FeO |