题目内容
1.在配制一定物质的量浓度的NaOH溶液时,下列说法正确的是( )| A. | 将称量NaOH固体时在烧杯中溶解后立即转移到容量瓶中 | |
| B. | 向容量瓶中加水定容时俯视 所配溶液浓度偏高 | |
| C. | 配制NaOH溶液不需用到量筒 | |
| D. | 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 |
分析 A.称量NaOH固体时在烧杯中溶解,放出热量,应冷却后转移;
B.向容量瓶中加水定容时俯视,V偏小;
C.浓溶液配制稀溶液时,可利用量筒量取浓溶液;
D.定容后摇匀,发现液面降低,为正常现象.
解答 解:A.称量NaOH固体时在烧杯中溶解,放出热量,应冷却后转移,防止V偏小,故A错误;
B.向容量瓶中加水定容时俯视,V偏小,由c=$\frac{n}{V}$可知,浓度偏高,故B正确;
C.浓溶液配制稀溶液时,可利用量筒量取浓溶液,若固体配制溶液时可不用量筒,故C错误;
D.定容后摇匀,发现液面降低,为正常现象,不需要补加少量水,故D错误;
故选B.
点评 本题考查配制一定浓度的溶液,为高频考点,把握配制溶液的操作、误差分析为解答的关键,侧重分析与实验能力的考查,注意结合c=$\frac{n}{V}$分析误差,题目难度不大.

练习册系列答案
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
12.在体积不变的400℃恒温密闭容器中,一定量的SO2与1mol O2在催化剂作用下发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-Q KJ•mol-1,当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
| A. | 增大氧气浓度,平衡向正方向移动,K值不变 | |
| B. | 平衡时SO2气体的转化率为50% | |
| C. | 该条件下反应放出0.5QkJ的热量 | |
| D. | 降低温度,正反应速率比逆反应速率减小的程度小 |
9.下列反应中,水作氧化剂的是( )
| A. | C+H2O $\frac{\underline{\;\;△\;\;}}{\;}$ CO+H2 | B. | H2+CuO $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | ||
| C. | Cl2+H2O?HCl+HClO | D. | SO3+H2O═H2SO4 |
6.在无色溶液中,下列各组离子能大量共存的是( )
| A. | K+、SO42-、Cl-、NH4+ | B. | Na+、NO3-、Ag+、CO32- | ||
| C. | Na+、Cl-、NO3-、Cu2+、 | D. | K+、HCO3-、SO42-、OH |
13.某烯烃和炔烃的混合气体,其密度是相同条件下氢气密度的13.8倍,将1L混合气体燃烧,在同温同压下得到2.1LCO2气体.则该混合烃可能是( )
| A. | C2H4和C2H2 | B. | C2H4和C3H4 | C. | C3H6和C2H2 | D. | C3H6和C3H4 |
10.下列实验操作正确的是( )
| A. | 用干燥的PH试纸可以确定某气体是否是氨气 | |
| B. | 在含有FeCl2杂质的FeCl3溶液中通入足量Cl2后,充分加热,可得到纯净的FeCl3溶液 | |
| C. | 中和热测定实验中,碱液要一次性加入,以防止热量损失 | |
| D. | 为减小中和滴定误差,锥形瓶必须用待测液润洗后才能使用 |
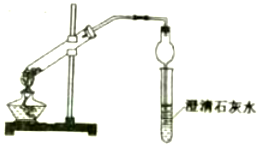 现有两瓶白色固体分别是碳酸钠固体与碳酸氢钠固体,某同学利用多种方法进行鉴别:
现有两瓶白色固体分别是碳酸钠固体与碳酸氢钠固体,某同学利用多种方法进行鉴别: