题目内容
9.将一定量的氯气通入50mL 10.00mol•L-1的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、NaClO3共存体系(不考虑氯气和水的反应).下列说法正确的是( )| A. | 若反应中转移的电子为nmol,则0.25<n<0.5 | |
| B. | 溶液中n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 | |
| C. | 与NaOH反应的氯气物质的量:0.25 mol<n (Cl2)<0.75mol | |
| D. | 当溶液中n(NaClO):n(NaClO3)=5:1时,反应的离子方程式为:8Cl2+16OH-═10Cl-+5ClO-+ClO3-+8H2O |
分析 n(NaOH)=10.00mol/L×0.05L=0.5mol,
A.氯气和NaOH反应有2NaOH+Cl2=NaCl+NaClO+H2O、6 NaOH+3Cl2=5NaCl+NaClO3+3H2O,当生成NaCl和NaClO时转移电子最少,当生成NaCl和NaClO3时转移电子最多;
B.令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,根据电子转移守恒验证判断;
C.氯气和NaOH反应有2NaOH+Cl2=NaCl+NaClO+H2O、6 NaOH+3Cl2=5NaCl+NaClO3+3H2O,采用极限法计算;
D.根据得失电子守恒和原子守恒配平.
解答 解:n(NaOH)=10.00mol/L×0.05L=0.5mol,
A.氯气和NaOH反应有2NaOH+Cl2=NaCl+NaClO+H2O、6 NaOH+3Cl2=5NaCl+NaClO3+3H2O,当生成NaCl和NaClO时转移电子最少,0.5molNaOH消耗0.25molCl2,生成0.25molNaCl转移电子的物质的量为0.25mol;当生成NaCl和NaClO3时,0.5molNaOH消耗0.25molCl2,生成0.42molNaCl转移电子的物质的量为0.42mol,所以如果反应中转移的电子为n mol,则0.25<n<0.42,故A错误;
B.令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故B错误;
C.若氯气和NaOH只发生反应2NaOH+Cl2=NaCl+NaClO+H2O,则消耗氯气为0.25mol,若只发生反应6 NaOH+3Cl2=5NaCl+NaClO3+3H2O,消耗的氯气为0.25mol,所以与NaOH反应的氯气物质的量为0.25mol,故C错误;
D.当溶液中n(NaClO):n(NaClO3)=5:1时,则Cl原子失去的电子数为10,生成NaCl得到的电子数为1,所以NaCl的计量数为10,反应的离子方程式为:8Cl2+16OH-═10Cl-+5ClO-+ClO3-+8H2O,故D正确.
故选D.
点评 本题考查氧化还原反应计算、根据方程式的计算等,难度较大,注意利用极限法、电子守恒和原子守恒法的利用,侧重于考查学生的分析能力和计算能力.

| A. | 正极发生还原反应 2O2+4H2O+8e-═8OH- | |
| B. | 通入CH4的电极为负极 | |
| C. | 该电池使用一段时间后应补充KOH | |
| D. | 燃料电池工作时,溶液中的OH-向正极移动 |
| A. | 3 | B. | 7 | C. | 8 | D. | 11 |
| A. | 标准状况下,2.24 Cl2完全反应生成FeCl3或CuCl2,转移的电子数都为0.2NA | |
| B. | 18g D2O中含有的电子数为10 NA | |
| C. | pH=12的氨水中含有NH4+的数目为0.01 NA | |
| D. | 28g 由乙烯和CO组成的混合物中含有的原子总数为3NA |
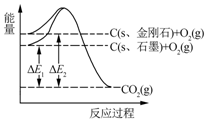
| A. | 1 mol石墨完全转化为金刚石需吸收1.9 kJ热量 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 1 mol金刚石和1 mol O2化学键断裂吸收的能量总和大于1 mol CO2分子中化学键断裂吸收的能量 |
| A. | 分子式为C5H10O2且能与Na2CO3溶液反应产生气体的有机物的同分异构体有4种 | |
| B. | 用酸性高锰酸钾溶液既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 | |
| C. | 乙烷和氯气制氯乙烷和乙烯与氯化氢反应制氯乙烷反应类型不同 | |
| D. | 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体 |
| A. | 糖类是人体能量的主要来源 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 天然存在的动植物油脂,大多属于单甘油酯 | |
| D. | 乙烯可作水果催熟剂,能促进水果尽早成熟 |
| A. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质 | |
| C. | 城际“轻轨电车”启动时,电车电刷与导线的接触点会产生高温,石墨可用作接触点上的材料 | |
| D. | 中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦,采用低温提取,解决了关键性的技术难题.青蒿素的提取属于化学变化 |