题目内容
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10 分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2=HCN+NaNO2 NaCN+HF=HCN+NaF NaNO2+HF=HNO2+NaF由此可判断下列叙述不正确的是( )
| A、K(HF)=7.2×10-4 |
| B、K(HNO2)=4.9×10-10 |
| C、根据两个反应即可得出结论 |
| D、Ka(HCN)<Ka(HNO2 ) |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:相同温度下,酸的电离常数越大,该酸的酸性越强,强酸能和弱酸的盐反应生成弱酸,根据NaCN+HNO2→HCN+NaNO2、NaCN+HF→HCN+NaF、NaNO2+HF→HNO2+NaF知,酸的强弱顺序是HCN<HNO2<HF,则酸的电离平衡常数大小顺序为K(HCN)<K(HNO2)<K(HF),据此分析解答.
解答:
解:相同温度下,酸的电离常数越大,该酸的酸性越强,强酸能和弱酸的盐反应生成弱酸,根据NaCN+HNO2→HCN+NaNO2、NaCN+HF→HCN+NaF、NaNO2+HF→HNO2+NaF知,酸的强弱顺序是HCN<HNO2<HF,则酸的电离平衡常数大小顺序为K(HCN)<K(HNO2)<K(HF),
A.通过以上分析知,K(HF)最大为7.2×10-4,故A正确;
B.根据以上分析知,K(HNO2)处于中间状态,为4.6×10-4,故B错误;
C.根据NaCN+HNO2→HCN+NaNO2、NaCN+HF→HCN+NaF即可得出结论,故C正确;
D.通过以上分析知,酸的电离平衡常数大小顺序为K(HCN)<K(HNO2)<K(HF),故D正确;
故选B.
A.通过以上分析知,K(HF)最大为7.2×10-4,故A正确;
B.根据以上分析知,K(HNO2)处于中间状态,为4.6×10-4,故B错误;
C.根据NaCN+HNO2→HCN+NaNO2、NaCN+HF→HCN+NaF即可得出结论,故C正确;
D.通过以上分析知,酸的电离平衡常数大小顺序为K(HCN)<K(HNO2)<K(HF),故D正确;
故选B.
点评:本题考查了弱电解质的电离,明确酸的强弱及其电离平衡常数的关系是解本题关键,结合强酸制取弱酸来分析解答,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案
相关题目
制取硝酸铜现有三种设计方案可供选用:
①Cu与稀硝酸反应 3Cu+8HNO3=3Cu(NO)2+2NO↑+4H2O
②Cu与浓硝酸反应 Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中 2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
下列说法正确的是( )
①Cu与稀硝酸反应 3Cu+8HNO3=3Cu(NO)2+2NO↑+4H2O
②Cu与浓硝酸反应 Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中 2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
下列说法正确的是( )
| A、制取相同量的硝酸铜时,③需硝酸的量最少 |
| B、制取相同量的硝酸铜时,①产生的有毒气体比②少 |
| C、三种方案中硝酸的利用率③>②>① |
| D、三种方案的反应都可以在铁制容器中进行 |
将下列物质按酸、碱、盐分类排列,正确的是( )
| A、硫酸、纯碱、CaSO4 |
| B、盐酸、烧碱、CuSO4 |
| C、HNO3、乙醇、氯化钠 |
| D、碳酸、CaO、苛性钠 |
在如图所示的两个电化学装置中,连接灵敏电流计的并接通电路,两个电流计的指针均明显 偏转,下列说法错误的是( )
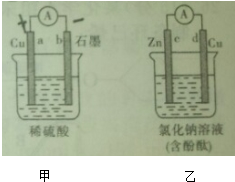

| A、甲溶液中H+的移动方向是a→b |
| B、b电极上的电极反应式为:2H++2e-═H2↑ |
| C、一段时间后,d电极附近的溶液变红 |
| D、乙装置中的溶液会逐渐变浑浊 |
下列叙述中,能证明某物质是弱电解质的是( )
| A、熔化时不导电 |
| B、不是离子化合物,而是极性共价化合物 |
| C、溶液中已电离的离子和未电离的分子共存 |
| D、水溶液的导电能力很差 |
14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,对上述反应下列各项判断正确的是( )
| A、反应中的氧化剂只有CuSO4 |
| B、7 mol CuSO4能氧化5mol-1价的硫 |
| C、被氧化的硫和被还原的硫个数之比是3:7 |
| D、FeS2既是氧化剂,又是还原剂 |