题目内容
13.下列关于金属元素特征的叙述,正确的是( )①金属元素的原子只有还原性,离子只有氧化性
②金属元素在化合物中一般显正价
③金属性越强的元素相应的离子氧化性越弱
④金属元素的原子最外层电子数都少于4.
| A. | ①②③ | B. | ②③ | C. | ①③④ | D. | 全部 |
分析 金属元素的化合价一定是正价,其原子只有还原性,但其离子不一定只有氧化性,如Fe2+就有还原性,金属性越强的元素相应的离子氧化性越弱,第VA族的金属元素的最外层有5个电子,据此分析.
解答 解:①对于多价金属离子来说,较低价态的金属离子既有氧化性又有还原性,例Fe2+,Fe2++Zn=Fe+Zn2+,2Fe2++Cl2═2Fe3++2Cl-,故①错误;
②因为金属元素的原子只具有还原性,故在化合物中只显正价,故②正确;
③金属性越强的元素越易失去电子,单质的还原性越强,对应的离子越难以得电子,氧化性越弱,故③正确;
④第VA族的金属元素的最外层有5个电子,所以金属元素的原子最外层电子数不一定少于4,故④错误.
故选B.
点评 本题考查金属的性质,题目难度不大,注意对于此类结论性判断,只要能举出相反的例子,即可证明叙述错误.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
1.下列各组离子一定能大量共存的是( )
| A. | 在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 25℃,在c(H+)=10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 能使广泛pH试纸显蓝色的溶液中:Na+、K+、AlO2-、CO32- | |
| D. | 25℃,在pH=0的溶液中:K+、Fe2+、Cl-、NO3- |
8.四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,X、W质子数之和是Z质子数的2倍.则下列说法中正确的是( )
| A. | 原子半径比较:X<Y<Z<W | |
| B. | Y的氢化物沸点高于W的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,w的最高价氧化物的水化物酸性最强 |
18.下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )
| A. | FeCl3 | B. | Cu(NO3)2 | C. | Na2SO3 | D. | NaAlO2 |
5.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 标况下,22.4L单质溴所含有的原子数目为2NA | |
| C. | 2L 0.5 mol/L硫酸溶液中含有氢原子数目为2NA | |
| D. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA |
2.对如图两种化合物的结构或性质描述错误的是( )
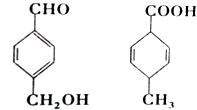

| A. | 互为同分异构体 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 均可以发生加成和取代反应 | |
| D. | 既能用红外光谱区分,也可以用核磁共振氢谱区分 |
3.下列化学方程式中能用H++OH-═H2O表示的是( )
| A. | NH3•H2O+HCl═NH4Cl+H2O | B. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | ||
| C. | Al(OH)3+3HCl═AlCl3+3H2O | D. | KOH+HNO3═KNO3+H2O |
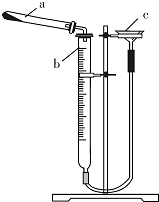 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.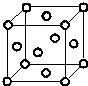 Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素.
Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素.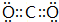 ,分子的空间构型是直线形;Z3+的原子结构示意图为
,分子的空间构型是直线形;Z3+的原子结构示意图为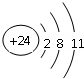 ;X2Q4分子中X原子的杂化方式为sp3杂化.
;X2Q4分子中X原子的杂化方式为sp3杂化.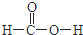 ,m g该物质完全燃烧后通过足量Na2O2固体充分吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g
,m g该物质完全燃烧后通过足量Na2O2固体充分吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g