题目内容
用NA表示阿伏加德罗常数的值,下列关于0.2mol/L的Ca(NO3)2溶液的说法不正确的是( )
| A、2L溶液中阴、阳离子的总数为1.2NA |
| B、500mL溶液中NO3-的浓度为0.2mol/L |
| C、500mL溶液中Ca2+的浓度为0.2mol/L |
| D、500mL溶液中NO3-的总数为0.2NA |
考点:物质的量浓度的相关计算
专题:
分析:A.根据N=化学式中阴阳离子个数×c[Ca(NO3)2]?V?NA计算;
B.根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
C.根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
D.根据n(NO3-)=2c[Ca(NO3)2]V计算;
B.根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
C.根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
D.根据n(NO3-)=2c[Ca(NO3)2]V计算;
解答:
解:A.N(阴阳离子数)=3×c[Ca(NO3)2]2V NA=3×0.2mol/L×2L×NA=1.2NA,故A正确;
B.0.2mol?L-1的Ca(NO3)2溶液中:c(NO3-)=2×c[Ca(NO3)2)]=2×0.2mol/L=0.4mol/L,故B错误;
C.c(Ca2+)=1×c[Ca(NO3)2]=1×0.2mol/L=0.2mol/L,故C正确;
D.n(NO3-)=2 c[Ca(NO3)2]V=2×0.2mol/L×0.5L=0.2mol,NO3-总数为0.2NA,故D正确;
故选B.
B.0.2mol?L-1的Ca(NO3)2溶液中:c(NO3-)=2×c[Ca(NO3)2)]=2×0.2mol/L=0.4mol/L,故B错误;
C.c(Ca2+)=1×c[Ca(NO3)2]=1×0.2mol/L=0.2mol/L,故C正确;
D.n(NO3-)=2 c[Ca(NO3)2]V=2×0.2mol/L×0.5L=0.2mol,NO3-总数为0.2NA,故D正确;
故选B.
点评:本题考查了有关物质的量浓度的计算,题目难度不大,注意掌握物质的量浓度的概念及计算方法,明确化学式与离子的关系是解本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列叙述正确的是( )
| A、直径介于1~10nm之间的微粒称为胶体 |
| B、NaOH溶液中滴加FeCl3溶液制得Fe(OH)3胶体 |
| C、利用丁达尔效应可以区别溶液与胶体 |
| D、过滤可以分离胶体粒子与溶液中的溶质粒子 |
用NaOH溶液滴定盐酸时,由于滴定速率太快,当混合溶液变红时,不知NaOH是否过量,判断它是否过量的方法是( )
| A、加入5mL盐酸进行滴定 |
| B、返滴一滴待测盐酸 |
| C、重新进行滴定 |
| D、以上方法均不适用 |
利用下列实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤作用的活性物质.下列说法错误的是( )
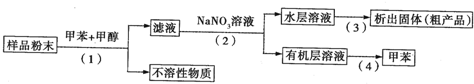

| A、步骤(1)需要过滤装置 |
| B、活性物质易溶于有机溶剂,难溶于水 |
| C、步骤(3)需要用到蒸发皿 |
| D、步骤(4)是利用物质的沸点差异进行分离的 |
进行化学实验必须注意安全,下列说法不正确的是( )
| A、不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,应立即用大量的水冲洗 |
| C、加热试管或烧杯时,应首先擦干外壁上的水 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法.流程如下下列有关说法正确的是( )
CrOH42-
Cr2O72-→
Cr3+
Cr(OH)3↓
其中第①步中存在平衡:2CrO42-(黄色)+2H+???Cr2O72-(橙色)+H2O.
CrOH42-
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| 沉淀剂 |
| ③沉淀 |
其中第①步中存在平衡:2CrO42-(黄色)+2H+???Cr2O72-(橙色)+H2O.
| A、第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态 |
| B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C、常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9 |
| D、第②步中,还原0.1 mol Cr2O72-需要91.2 g FeSO4 |


