题目内容
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=a kJ mol-1
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ mol-1②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ mol-1则a= kJ mol-1.
(2)在T℃时,该反应的平衡常数K=64,在2L 恒容密闭容器甲和乙中,分别按表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO 的平衡转化率为 .
②下列说法正确的是(填字母) .
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO 的平衡转化率大于乙的
c.甲、乙容器中,CO 的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO 的转化率
(3)采取一定措施可防止钢铁腐蚀.如图装置中的烧杯里均盛有等浓度、等体积的NaCl 溶液.
①在a~c 装置中,能保护铁的是 (填字母).
②若用d 装置保护铁,X 极的电极材料应是 (填名称).
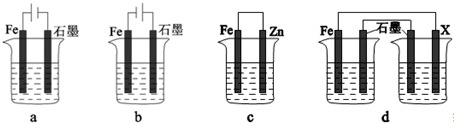
③写出C中铁电极的反应方程式
(4)CO2溶于水生成H2CO3,已知:常温下,H2CO3和HClO 的电离常数如下:
H2CO3═H++HCO3- Ka1=4.2xl0-7 mol?L-1
HCO3═H++CO32- Ka2=5.6x1O-11 mol?L-1
HClO═H++ClO- Ka=4.7x1O-8 mol?L-1
①0.1mol?L-1 NaHCO3溶液中C(H+) C(H2CO3) (填“<”“=”“>”)
②写出氯气和碳酸钠物质的量之比为1:1 时发生反应的离子方程式 .
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ mol-1②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ mol-1则a=
(2)在T℃时,该反应的平衡常数K=64,在2L 恒容密闭容器甲和乙中,分别按表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是(填字母)
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO 的平衡转化率大于乙的
c.甲、乙容器中,CO 的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO 的转化率
(3)采取一定措施可防止钢铁腐蚀.如图装置中的烧杯里均盛有等浓度、等体积的NaCl 溶液.
①在a~c 装置中,能保护铁的是
②若用d 装置保护铁,X 极的电极材料应是

③写出C中铁电极的反应方程式
(4)CO2溶于水生成H2CO3,已知:常温下,H2CO3和HClO 的电离常数如下:
H2CO3═H++HCO3- Ka1=4.2xl0-7 mol?L-1
HCO3═H++CO32- Ka2=5.6x1O-11 mol?L-1
HClO═H++ClO- Ka=4.7x1O-8 mol?L-1
①0.1mol?L-1 NaHCO3溶液中C(H+)
②写出氯气和碳酸钠物质的量之比为1:1 时发生反应的离子方程式
考点:化学平衡的计算,有关反应热的计算,金属的电化学腐蚀与防护,弱电解质在水溶液中的电离平衡
专题:
分析:(1)依据热化学方程式和盖斯定律计算;
(2)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态;
b.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率;
c.依据平衡三段式计算平衡物质的量;计算甲、乙容器中,CO的平衡浓度之比;
d.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率;
(3)①原电池的正极和电解池的阴极可以得到保护;
②装置为原电池,若用d装置保护铁,X极的电极材料应比铁活泼;
③C是吸氧腐蚀,铁为正极,溶液中氧气得到电子生成氢氧根离子;
(4)①0.1mol?L-1 NaHCO3溶液中C(H+)<C(H2CO3),碳酸氢根离子水解程度大于碳酸氢根离子的电离程度;
②氯气和碳酸钠按照1:1的比例恰好反应,生成的盐酸恰好和碳酸钠反应生成碳酸氢钠,次氯酸不参与反应.
(2)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态;
b.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率;
c.依据平衡三段式计算平衡物质的量;计算甲、乙容器中,CO的平衡浓度之比;
d.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率;
(3)①原电池的正极和电解池的阴极可以得到保护;
②装置为原电池,若用d装置保护铁,X极的电极材料应比铁活泼;
③C是吸氧腐蚀,铁为正极,溶液中氧气得到电子生成氢氧根离子;
(4)①0.1mol?L-1 NaHCO3溶液中C(H+)<C(H2CO3),碳酸氢根离子水解程度大于碳酸氢根离子的电离程度;
②氯气和碳酸钠按照1:1的比例恰好反应,生成的盐酸恰好和碳酸钠反应生成碳酸氢钠,次氯酸不参与反应.
解答:
解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
依据盖斯定律①-②×3得到
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a=-28.5;
故答案为:-28.5;
(2)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
平衡常数K=
=
=64,计算得到x=0.6
转化率=60%;
故答案为:60%;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故a正确;
b.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,故b错误;
c.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3;故c正确;
d.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故d错误;
故答案为:ac;
(3)①装置中原电池的正极和电解池的阴极可以得到保护,故答案为:bc;
②装置为原电池,若用d装置保护铁,X极的电极材料应比铁活泼可以选择锌,故答案为:锌;
③C是吸氧腐蚀,铁为正极,溶液中氧气得到电子生成氢氧根离子;电极反应为:O2+2H2O+4e-=4OH-;
故答案为:O2+2H2O+4e-=4OH-;
(4)①碳酸氢根离子水解程度大于碳酸氢根离子的电离程度,0.1mol?L-1 NaHCO3溶液中C(H+)<C(H2CO3);
故答案为:<;
②氯气和碳酸钠按照1:1的比例恰好反应,生成的盐酸恰好和碳酸钠反应生成碳酸氢钠,次氯酸不参与反应,反应的离子方程式为:Cl2+CO32-+H2O═HCO3-+Cl-+HClO,
故答案为:Cl2+CO32-+H2O═HCO3-+Cl-+HClO.
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
依据盖斯定律①-②×3得到
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a=-28.5;
故答案为:-28.5;
(2)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
平衡常数K=
| c3(CO2) |
| c3(CO) |
| (1+x)3 |
| (1-x)3 |
转化率=60%;
故答案为:60%;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故a正确;
b.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,故b错误;
c.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3;故c正确;
d.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故d错误;
故答案为:ac;
(3)①装置中原电池的正极和电解池的阴极可以得到保护,故答案为:bc;
②装置为原电池,若用d装置保护铁,X极的电极材料应比铁活泼可以选择锌,故答案为:锌;
③C是吸氧腐蚀,铁为正极,溶液中氧气得到电子生成氢氧根离子;电极反应为:O2+2H2O+4e-=4OH-;
故答案为:O2+2H2O+4e-=4OH-;
(4)①碳酸氢根离子水解程度大于碳酸氢根离子的电离程度,0.1mol?L-1 NaHCO3溶液中C(H+)<C(H2CO3);
故答案为:<;
②氯气和碳酸钠按照1:1的比例恰好反应,生成的盐酸恰好和碳酸钠反应生成碳酸氢钠,次氯酸不参与反应,反应的离子方程式为:Cl2+CO32-+H2O═HCO3-+Cl-+HClO,
故答案为:Cl2+CO32-+H2O═HCO3-+Cl-+HClO.
点评:本题考查了热化学方程式书写和盖斯定律计算应用,化学平衡常数概念的计算分析,化学平衡影响因素的理解应用,原电池原理和盐类水解的判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列关于有机物的叙述正确的是( )
| A、石油的分馏和裂化均属于化学变化 |
| B、乙醇、乙酸能用碳酸钠溶液、紫色石蕊溶液、酸性高锰酸钾溶液等多种方法鉴别 |
| C、油脂、塑料、天然橡胶都是高分子化合物 |
| D、因为葡萄糖在糖类结构中最简单,因此它是一种单糖 |
下列叙述正确的是( )
| A、甲苯、苯乙烯都能使酸性高锰酸钾溶液褪色,也都能与溴的四氯化碳溶液反应而褪色 |
| B、天然气和液化石油气的主要成分都是烃 |
| C、溴乙烷和乙醇在相同的反应条件下都可以生成乙烯 |
| D、石蜡是从石油中获取的油脂 |
常温下,水的离子积为Kw,下列说法正确的是( )
| A、在pH=11的溶液中,水电离出的c(OH-)一定等于10-3mol/L |
| B、将pH=1的酸和pH=13的碱溶液等体积混合后,溶液的pH一定等于7 |
| C、一元酸HA与一元碱BOH混合后,溶液中c(A-)=c(B+),则溶液呈中性 |
| D、若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 |
下列叙述正确的是( )
| A、当温度升高时,弱酸的电离平衡常数Ka变小 |
| B、某温度下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L |
| C、由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生 |
| D、常温下,pH=12氨水与pH=2盐酸等体积混合c(Cl-)>c(NH+4)>c(H+)>c(OH-) |
下列物质的保存方法正确的是( )
①少量金属钠保存在冷水中
②浓硝酸盛放在棕色试剂瓶中
③少量金属钾保存在煤油中
④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中
⑤液溴保存在带橡胶塞的棕色细口瓶中.
①少量金属钠保存在冷水中
②浓硝酸盛放在棕色试剂瓶中
③少量金属钾保存在煤油中
④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中
⑤液溴保存在带橡胶塞的棕色细口瓶中.
| A、③④ | B、①③④ |
| C、②③④ | D、③④⑤ |
下列说法中正确的是( )
| A、常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化 |
| B、乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
| C、玛瑙、水晶、钻石的主要成分均为SiO2 |
| D、蛋白质、纤维素、蔗糖、天然橡胶都是高分子化合物 |
下列关于有机化合物的叙述正确的是( )
| A、用NaOH溶液可以除去乙酸乙酯中的乙酸 |
| B、乙烯和苯都能与溴水反应而使溴水褪色 |
| C、用新制的银氨溶液可区分甲酸甲酯和乙醛 |
| D、脂肪、糖类和蛋白质都是人体重要的营养物质 |
短周期主族元素A、B、C、D的原子序数依次增大.它们的原子序数之和为25,原子最外层电子数之和为
11. A与D同主族,且在周期表的S区.B与C是同周期相邻元素.则下列叙述正确的是( )
11. A与D同主族,且在周期表的S区.B与C是同周期相邻元素.则下列叙述正确的是( )
| A、四种元素的原子半径:A<B<C<D |
| B、四种元素A、B、C、D的氧化物都不止一种 |
| C、由B与A组成的化合物的沸点一定低于由C与A组成的化合物的沸点 |
| D、CaA2、CaB2这两种化合物中,阳离子与阴离子个数比均为1:2 |