题目内容
10.有机物E是合成某药物的中间体,化合物E与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构;有机物N可转化为G、F,且生成的G、F物质的量之比为n(G):n(F)=1:3,1mol G与足量的金属钠反应产生H2 33.6L(标准状况).各物质间的转化流程如下(无机产物省略):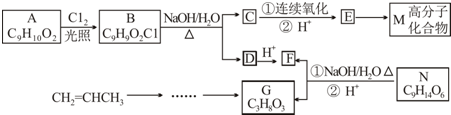
已知:①-ONa连在烃基上不会被氧化;
②同一个碳原子上连接2个-OH不稳定
请回答:
(1)E的结构简式
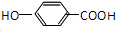 .
.(2)下列说法不正确的是D.
A.化合物B、F都能发生取代反应
B.化合物A、G都能发生氧化反应
C.一定条件下,化合物F与G反应生成N,还可生成分子组成为C7H12O5和C5H10O4的化合物
D.从化合物A到M的转化过程中,涉及到的反应类型有取代反应、氧化反应、消去反应和缩聚反应
(3)写出B转化为C和D的化学方程式
 .
.(4)写出符合下列条件的化合物A的所有同分异构体的结构简式:
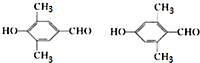 .
.①含有苯环,且苯环上的一元取代物只有一种
②能与新制氢氧化铜悬浊液反应生成砖红色沉淀,且能与氯化铁溶液发生显色反应
(5)设计以CH2=CHCH3为原料制备G的合成路线(用流程图表示,无机试剂任选)
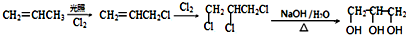 . (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)
. (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)
分析 N碱性条件下水解、酸化生成的G、F物质的量之比为n(G):n(F)=1:3,则N中含有酯基,F分子中含有2个C原子,1 mol G与足量的金属钠反应产生H2 为$\frac{33.6L}{22.4L/mol}$=1.5mol,结合G的分子式可知G中含有3个羟基,则G为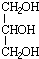 ,F为CH3COOH,N为
,F为CH3COOH,N为 .
.
化合物E与氯化铁溶液发生显色反应,说明E中含有苯环与酚羟基,由转化关系可知A中含有苯环与酚羟基,A与氯气在光照条件下发生侧链上取代反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C与D,D酸化得到F(乙酸),则D为CH3COONa,则C中含有7个C原子,C连续发生氧化反应,酸化得到E,说明C中含有-CH2OH结构,E中含有羧基,且E环上的一元取代物只有两种结构,则E为 ,
,
C为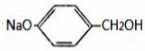 ,B为
,B为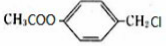 ,A为
,A为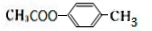 .CH2═CHCH3在光照条件下与氯气发生取代反应生成CH2═CHCH2Cl,然后与氯气发生加成反应生成ClCH2CHClCH2Cl,最后在氢氧化钠水溶液、加热条件下发生水解反应得到
.CH2═CHCH3在光照条件下与氯气发生取代反应生成CH2═CHCH2Cl,然后与氯气发生加成反应生成ClCH2CHClCH2Cl,最后在氢氧化钠水溶液、加热条件下发生水解反应得到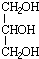 .
.
解答 解:N碱性条件下水解、酸化生成的G、F物质的量之比为n(G):n(F)=1:3,则N中含有酯基,F分子中含有2个C原子,1 mol G与足量的金属钠反应产生H2 为$\frac{33.6L}{22.4L/mol}$=1.5mol,结合G的分子式可知G中含有3个羟基,则G为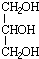 ,F为CH3COOH,N为
,F为CH3COOH,N为 .
.
化合物E与氯化铁溶液发生显色反应,说明E中含有苯环与酚羟基,由转化关系可知A中含有苯环与酚羟基,A与氯气在光照条件下发生侧链上取代反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C与D,D酸化得到F(乙酸),则D为CH3COONa,则C中含有7个C原子,C连续发生氧化反应,酸化得到E,说明C中含有-CH2OH结构,E中含有羧基,且E环上的一元取代物只有两种结构,则E为 ,
,
C为 ,B为
,B为 ,A为
,A为 .
.
(1)由上述分析可知,E的结构简式: ,故答案为:
,故答案为: ;
;
(2)A.B为 ,可以发生水解反应,属于取代反应,F为CH3COOH,可以发生酯化反应,属于取代反应,故A正确;
,可以发生水解反应,属于取代反应,F为CH3COOH,可以发生酯化反应,属于取代反应,故A正确;
B.A为 ,甲基会被酸性高锰酸钾溶液氧化,G为
,甲基会被酸性高锰酸钾溶液氧化,G为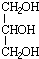 ,醇羟基可发生氧化反应,故B正确;
,醇羟基可发生氧化反应,故B正确;
C.F为CH3COOH,G为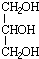 ,二者2:1反应生成C7H12O5,1:1反应生成C5H10O4,故C正确;
,二者2:1反应生成C7H12O5,1:1反应生成C5H10O4,故C正确;
D.从化合物A到M的转化过程中,没有涉及消去反应,故D错误,
故选:D;
(3)B转化为C和D的化学方程式: ,
,
故答案为: ;
;
(4)符合下列条件的化合物A( )的所有同分异构体的结构简式:
)的所有同分异构体的结构简式:
①含有苯环,且苯环上的一元取代物只有一种,②能与新制氢氧化铜悬浊液反应生成砖红色沉淀,且能与氯化铁溶液发生显色反应,含有酚羟基与醛基,符合条件的同分异构体有: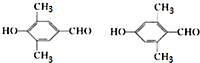 ,
,
故答案为: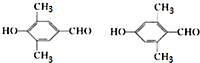 ;
;
(5)CH2═CHCH3在光照条件下与氯气发生取代反应生成CH2═CHCH2Cl,然后与氯气发生加成反应生成ClCH2CHClCH2Cl,最后在氢氧化钠水溶液、加热条件下发生水解反应得到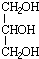 ,合成路线流程图为:
,合成路线流程图为: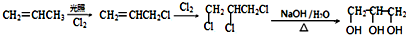 ,
,
故答案为: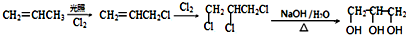 .
.
点评 本题考查有机物的推断与合成,根据有机物的分子式与性质进行分析解答,熟练掌握官能团的性质与转化,侧重考查学生分析推理能力、知识迁移运用,是有机化学常考题型.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案
| A. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| B. | Z位于元素周期表中第二周期,第ⅥA族 | |
| C. | X的气态氢化物的稳定性比Z的弱 | |
| D. | M的原子半径比Y的原子半径大 |

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3-、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05-0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示.

①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
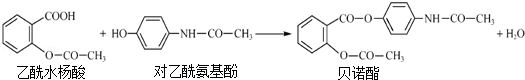
下列有关叙述正确的是( )
| A. | 1mol贝诺酯分子可与7molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
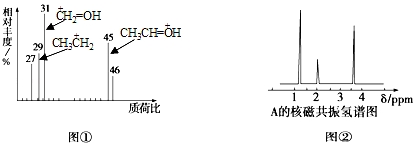
| A. | HCOOH | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2COOH |
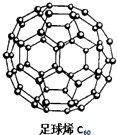 C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )| A. | C60、Si60、N60都属于新型化合物 | |
| B. | C60、Si60、N60分子内共用电子对数目相同 | |
| C. | 由于N-N键能小于N≡N,故N60的稳定性弱于N2 | |
| D. | 由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
| A. | 小于0.8 | B. | 大于1.2 | C. | 在0.8与1.2之间 | D. | 在0.8与1.5之间 |
| A. | CH3COONa | B. | CH3COOH和CH3COONa | ||
| C. | CH3COONa和NaOH | D. | CH3COOH和NaOH |
| A. | R气态氢化物化学式为H2R | |
| B. | R一定是Ⅵ族元素 | |
| C. | R的气态氢化物比同周期其他元素气态氢化物稳定 | |
| D. | R一定是第四周期元素 |