题目内容
(12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol?L-1Na2C2O4溶液(过量)和25mL6mol?L-1HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol?L-1KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol?L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13]
(2)步骤2滴定终点的现象是 。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
(12分)(1)pH≤8.5(2分);(2)溶液变成浅红色,且半分钟内不褪色(2分);(3)偏大(2分)
(4)样品溶解后,滴定消耗高锰酸钾:n(KMnO4)=0.01L×0.02000 mol·L-1=2.0×10-4mol(1分)
2MnO4-+ 5C2O42-+ 16H+=2Mn2++10CO2↑+8H2O
2.0×10-4mol 5.0×10-4mol (1分)
样品溶解过程所消耗的C2O42-的物质的量是:
0.025L×0.06000 mol/L—5.0×10-4mol=1.0×10-4mol (1分)
La2Ca2MnOx中Mn的化合价为(2x-10)(1分)
La2Ca2MnOx中锰得电子数与C2O42-失电子数相等:
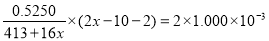 ,解得:x=7(2分)
,解得:x=7(2分)
【解析】
试题分析:(1)c(Mn2+)·c2(OH-)=Ksp (Mn(OH)2)=2.0×10-13; c2(OH-)=2.0×10-13÷0.02=1.0×10-11. c(OH-)=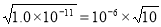 ,c(H+)=
,c(H+)=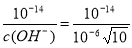 ,所以pH=8.5; (2)步骤2中用酸性KMnO4溶液滴定滴定Na2C2O4溶液时,若二者恰好完全反应,会看到溶液由无色变成浅红色,且半分钟内不褪色。即终点的现象是变成浅红色,且半分钟内不褪色;(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则酸性KMnO4溶液标准溶液的体积偏小,样品溶解过程所消耗的C2O42-量就偏大,所测x的值将偏大;(4) 样品溶解后,滴定消耗高锰酸钾溶液的物质的量是n(KMnO4)= 0.01L×0.02000 mol·L-1=2.0×10-4mol;Na2C2O4与酸性KMnO4溶液反应的离子方程式是:2MnO4-+5C2O42-+ 16H+=2Mn2++10CO2↑+8H2O,则根据离子方程式可知酸性KMnO4溶液反应消耗Na2C2O4的物质的量是n(C2O42-)=5/2 n(KMnO4)= 5.0×10-4mol;则样品溶解过程所消耗的C2O42-的物质的量是:n(C2O42-)= 0.025L×0.06000 mol/L—5.0×10-4mol=1.0×10-4mol;在La2Ca2MnOx中Mn的化合价为(2x-10),La2Ca2MnOx中锰得电子数与C2O42-失电子数相等,所以
,所以pH=8.5; (2)步骤2中用酸性KMnO4溶液滴定滴定Na2C2O4溶液时,若二者恰好完全反应,会看到溶液由无色变成浅红色,且半分钟内不褪色。即终点的现象是变成浅红色,且半分钟内不褪色;(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则酸性KMnO4溶液标准溶液的体积偏小,样品溶解过程所消耗的C2O42-量就偏大,所测x的值将偏大;(4) 样品溶解后,滴定消耗高锰酸钾溶液的物质的量是n(KMnO4)= 0.01L×0.02000 mol·L-1=2.0×10-4mol;Na2C2O4与酸性KMnO4溶液反应的离子方程式是:2MnO4-+5C2O42-+ 16H+=2Mn2++10CO2↑+8H2O,则根据离子方程式可知酸性KMnO4溶液反应消耗Na2C2O4的物质的量是n(C2O42-)=5/2 n(KMnO4)= 5.0×10-4mol;则样品溶解过程所消耗的C2O42-的物质的量是:n(C2O42-)= 0.025L×0.06000 mol/L—5.0×10-4mol=1.0×10-4mol;在La2Ca2MnOx中Mn的化合价为(2x-10),La2Ca2MnOx中锰得电子数与C2O42-失电子数相等,所以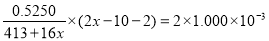 ,解得x=7。
,解得x=7。
考点:考查溶液pH的计算、滴定终点的判断、守恒方法、滴定方法在物质化学式确定中的应用的知识。

化学与社会、生活紧密相连。下列说法合理的是
| A.节日期间,在人群密集处燃放烟花爆竹 |
| B.寻找一种高效催化剂将水直接变成汽油 |
| C.炒菜时油锅中的油不慎着火,迅速盖上锅盖 |
| D.用点燃的火柴在液化气钢瓶口检验是否漏气 |
下列关于油脂的有关知识,说法不正确的是
| A.油脂都不能使溴水或酸性高锰酸钾溶液褪色 |
| B.油脂的饱和程度对油脂的熔点有着重要的影响 |
| C.油脂属于酯类物质 |
| D.食用油放在玻璃瓶中比放在塑料瓶中保存更科学 |
绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的的是
A.甲烷、CO合成乙酸乙酯:2CH4+2CO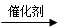 CH3COOCH2CH3 CH3COOCH2CH3 |
B.烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+ H2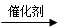 RCH2CH2CHO RCH2CH2CHO |
C.甲烷与氯气反应制氯仿:CH4+3Cl2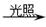 CHCl3+3HCl CHCl3+3HCl |
| D.乙烯合成聚乙烯 |