题目内容
6.下列物质工业生产主要原理不涉及氧化还原的是( )| A. | 纯碱 | B. | 烧碱 | C. | 盐酸 | D. | 硫酸 |
分析 有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化,据此结合各选项中涉及的反应判断.
解答 解:A.氨碱法制纯碱,是向氨化的饱和食盐水中通入二氧化碳反应生成碳酸氢钠;反应过程中无元素化合价变化,不是氧化还原反应,故A选;
B.工业用电解的方法制备烧碱,生成氢氧化钠、氢气和氯气,属于氧化还原反应,故B不选;
C.工业用氯气和氢气在点燃条件下制备,属于氧化还原反应,故C不选;
D.接触法制硫酸是利用黄铁矿燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫溶于水生成硫酸;前两步都是氧化还原反应,故D不选.
故选A.
点评 本题考查氧化还原反应、化学工业原理,侧重于化学与生产的考查,有利于培养学生良好的科学素养,明确各工业生成原理是解本题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式BF3[SO3( g)、BBr3等].
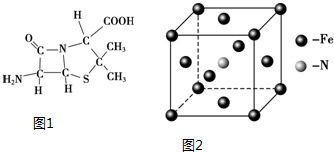
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(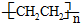 )分子中有5n个σ键
)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该反应的化学方程式8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2.若两个最近的Fe原子间的距离为s cm,则该晶体的密度是$\frac{119\sqrt{2}}{2{s}^{3}N{\;}_{A}}$g•mol-1.
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式BF3[SO3( g)、BBr3等].
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
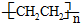 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
17. 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )
 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )| A. | 装置乙的b极要与装置甲的X极连接 | |
| B. | 装置乙中a极的电极反应式为2Cl--2e-═Cl2↑ | |
| C. | 若有机废水中主要含有葡萄糖,则装置甲中M的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | N电极发生还原反应,当N电极消耗56 L气体(标准状况下)时,则有2NA个H+通过离子交换膜 |
14.关于石油和石油化工的说法错误的是( )
| A. | 石油大体上是由各种碳氢化合物组成的混合物 | |
| B. | 石油分馏得到的各馏分是由各种碳氢化合物组成的混合物 | |
| C. | 石油裂解和裂化的主要目的都是为了得到重要产品乙烯 | |
| D. | 实验室里,在氧化铝粉末的作用下,用石蜡可以制出汽油 |
11.一种香豆素的衍生物结构如图所示,关于该有机物说法正确的是( )


| A. | 该有机物的分子式为C9H8O3 | |
| B. | 1mol该有机物与H2发生加成时最多消耗H25mol | |
| C. | 1mol该有机物与NaOH溶液反应时最多消耗NaOH2mol | |
| D. | 1mol该有机物与足量浓溴水反应时最多消耗Br23mol |
15.下列古代发明与所给化学变化对应错误的是( )
| 选项 | 古代发明 | 化学变化 |
| A | 生产陶瓷 | SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ |
| B | 黑火药爆炸 | S+2KNO3+3C$\frac{\underline{\;点燃\;}}{\;}$K2S+N2↑+3CO2↑ |
| C | 湿法炼铜 | CuSO4+Fe═Cu+FeSO4 |
| D | 用谷物酿酒 | (C6H10O5)n→C6H12O6→CH3CH2OH |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | 可逆反应的化学反应速率是指正反应速率 | |
| B. | 在可逆反应里正反应的速率是正值,逆反应的速率是负值 | |
| C. | 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度 | |
| D. | 对于可逆反应来说,反应物转化为生成物没有一定的限度 |
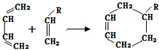 (或写成
(或写成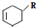 R代表取代基或氢)
R代表取代基或氢)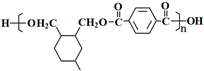 .
.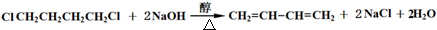 ;
;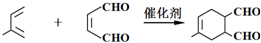 .
.
 ,属于弱电解质的是H2O、Al(OH)3.
,属于弱电解质的是H2O、Al(OH)3.