题目内容
12.下列说法不正确的是( )| A. | 用渗析的方法精制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | “钴酞菁”分子(直径为1.3×10-9米)在水中形成的分散系能产生丁达尔效应 | |
| D. | 冰醋酸、铝热剂、硫酸钡、SO2分别属于酸、混合物、强电解质、非电解质 |
分析 A、根据胶体不能透过半透膜分析;
B、二氧化硅是原子晶体,硅原子和氧原子按照1:2的个数比组成;
C、胶体的特性之一:丁达尔效应;
D、常见的电解质:酸、碱、盐、金属氧化物、水;非电解质:蔗糖、酒精、非金属氧化物和氨气;根据酸、混合物以及电解质和非电解质的概念来回答.
解答 解:A、胶体的微粒直径在1nm~100nm之间,不能透过半透膜,可用渗析的方法分离,故A正确;
B、二氧化硅是原子晶体,硅原子和氧原子按照1:2的个数比组成的,SiO2不能真实表示物质分子组成,故B错误;
C、“钴酞菁”分子(直径为1.3×10-9米)的微粒半径介于胶体分散系范围内,属于胶体分散系,具有丁达尔效应,故C正确;
D、冰醋酸电离出的阳离子全部是氢离子,属于酸,铝热剂是金属铝和氧化铁的混合物、硫酸钡属于盐,为强电解质、SO2的水溶液不是二氧化硫本身导电,属于非电解质,故D正确.
故选B.
点评 本题涉及物质的分类以及物质的分子构成各方面的知识,属于综合知识的考查,难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
17.下列不能与水反应的是( )
| A. | Fe | B. | Fe3O4 | C. | Na | D. | Na2O |
4.欲除去CuSO4•5H2O中的沙子,必要的实验操作为( )
| A. | 溶解 过滤 蒸发结晶 | B. | 加热 溶解 过滤 | ||
| C. | 溶解 过滤 蒸馏 | D. | 溶解 过滤 分液 |
1.短周期元素W、X、Y、Z在元素周期表中的位置如表所示.其中Z的单质是一种重要的半导体材料,广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位置是第二周期第ⅣA族.
(2)r(Yn+)<r(Xm-).(填“>”“﹦”“<”)
(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则A生成B的化学方程式为2Na+2NaOH+2H2O=2NaAlO2+3H2↑;B与C混合反应的离子方程式为Al3++3 AlO2-+6H2O=4Al(OH)3↓.
| W | X | ||
| Y | Z |
(2)r(Yn+)<r(Xm-).(填“>”“﹦”“<”)
(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则A生成B的化学方程式为2Na+2NaOH+2H2O=2NaAlO2+3H2↑;B与C混合反应的离子方程式为Al3++3 AlO2-+6H2O=4Al(OH)3↓.
2.下列反应属于氧化还原反应,又属于离子反应和化合反应的是( )
| A. | 硅和氢氧化钠溶液反应 | B. | 二氧化碳通入饱和Na2CO3溶液 | ||
| C. | 镁在二氧化碳中燃烧 | D. | 氯气通入到氯化亚铁溶液中 |
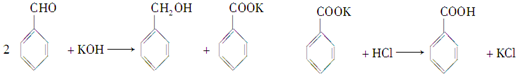
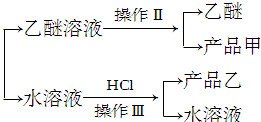
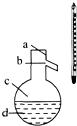 实验室制备苯甲醇和苯甲酸的化学原理是
实验室制备苯甲醇和苯甲酸的化学原理是